В великой симфонии жизни, непрерывно звучащей в каждой клетке нашего организма, одна из самых завораживающих глав – формирование третичной структуры белка. Этот процесс, полный тайн и загадок, является ключевым моментом в понимании механизма функционирования протеинов, основных строительных элементов живого мира. Можно сказать, что третичная структура белка – это сама генетическая душа, воплощенная в таинственном мире молекулярных связей и конформаций.
Комплексность процесса формирования третичной структуры белка непостижима для человеческого разума, но на протяжении долгих лет ученые постигают его суть, проникают в глубины молекулярного лабиринта. Весьма любопытно, что процесс формирования третичной структуры белка зачастую напоминает живописную игру пазлов, где искомое изображение скрывается среди бесчисленных вариантов его сочетаний. С постоянным исследовательским пылом ученые упорно находятся на краю континента знаний, проникая в секреты самой сути белкового мира.
Третичная структура белка представляет собой завораживающий ландшафт, где многообразные элементы пронизываются взаимодействиями и самоподобиями. В этом универсуме стабильности и гибкости, простоты и сложности, закономерности и редкостности, белки достигают своего полного потенциала, позволяя клеткам функционировать в гармонии. Многие способы формирования третичной структуры белка столь разнообразны, словно их можно сравнить с калейдоскопом, который постоянно меняет форму и цвета, но сохраняет в себе неповторимую гармонию и эстетику.
Важность третичной организации для эффективного функционирования белка
Третичная структура белка играет ключевую роль в его способности выполнять уникальные биохимические функции в организме. Эта организация обеспечивает пространственно-кусковость белка и определяет его активность и способность взаимодействовать с другими молекулами.
Значение третичной структуры для белка можно сравнить с ролью строительного плана для здания: только с учетом всех деталей и их взаимного расположения возможно создать функциональное и эффективное сооружение. Аналогично, третичная организация белка формирует его трехмерную архитектуру, которая в свою очередь определяет его специфичность и работоспособность.
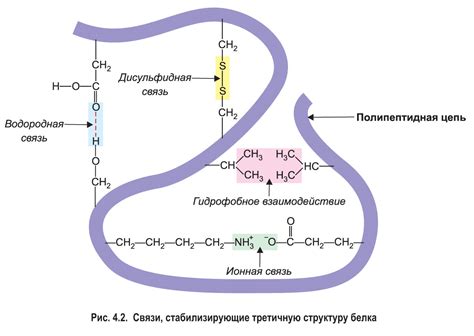
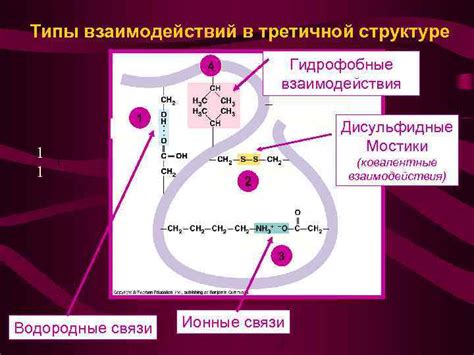
Третичная структура белка обусловлена сложными процессами его складывания и свертывания. Правильная формация третичной организации требует участия разнообразных механизмов и факторов: взаимодействий гидрофобных и гидрофильных остатков, образования водородных связей, ионных взаимодействий, гидрофобных эффектов и других физико-химических сил.
Только когда молекулярные цепи белка правильно свернуты и стабилизированы, он способен выполнять свои функции в организме. Нарушение третичной структуры может привести к потере активности белка или его отказу от выполнения своих биологических функций.
Важность третичной структуры для функционирования белка наглядно проявляется в разнообразии его ролей в организме: от участия в катализе химических реакций до передачи сигналов в клетках, от поддержания структурной целостности тканей до регуляции генной экспрессии.
Вместе с тем, третичная структура белка обладает гибкостью и динамичностью, что позволяет ему адаптироваться к изменяющимся условиям окружающей среды и выполнять различные функции в нашем организме.
Взаимодействие аминокислот в процессе складывания белковой структуры
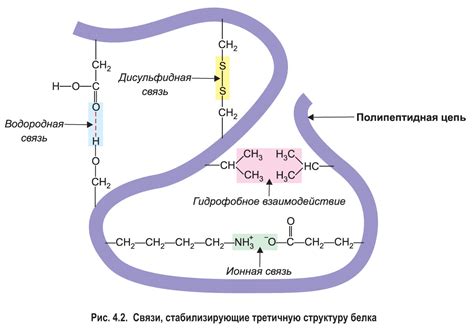
Аминокислоты, являясь основными строительными блоками белка, имеют различные свойства и химические группы. Их взаимодействие в процессе сворачивания белка происходит через образование химических связей, таких как ковалентные связи, водородные связи, ионные связи и взаимодействия Ван-дер-Ваальса. Образование этих связей определяет конформацию белка и его стерические свойства. Этот процесс представляет собой сложную молекулярную игру, где важную роль играют такие понятия, как гидрофобность, положенные расстояния и гибкость взаимодействующих аминокислотных остатков.
Особый интерес представляют гидрофобные взаимодействия, которые играют важнейшую роль в формировании пространственной структуры белка. Гидрофобные остатки аминокислот в организме стремятся избегать контакта с водой, что приводит к их сгустку и образованию гидрофобных ям и карманов внутри белковой молекулы. Эти области взаимодействуют друг с другом, обеспечивая устойчивость белковой структуры и помогая в процессе сворачивания.
Таким образом, взаимодействие аминокислот в процессе сворачивания белка играет важнейшую роль в формировании его третичной структуры. Этот процесс зависит от различных свойств аминокислот и их способности образовывать специфические связи. Глубокое понимание механизма и факторов, влияющих на взаимодействие аминокислот в процессе сворачивания белка, позволит улучшить наши знания о функциональных и структурных особенностях белков и применить их в решении различных научных и практических задач.
Влияние гидрофобных взаимодействий на формирование третичной конфигурации
При изучении процессов, связанных с созданием третичной структуры белка, невозможно обойти вниманием роль гидрофобных взаимодействий. Они играют ключевую роль в формировании уникальной пространственной конфигурации, определяющей функциональные свойства белка.
Гидрофобные взаимодействия являются энергетически выгодными связями между гидрофобными остатками аминокислот. Гидрофобные остатки обладают низкой аффинностью к воде и, поэтому, при интеракции друг с другом предпочитают образовывать гидрофобный контакт, минимизируя контакт с водой. В результате такого взаимодействия образуются внутренние гидрофобные ямки, которые стабилизируют третичную конфигурацию белка.
Гидрофобные взаимодействия способствуют сворачиванию полипептидной цепи в характерную нативную структуру. Они способны выталкивать поларные остатки аминокислот, а также способствуют формированию β-пластинки и α-спирали. Благодаря этим взаимодействиям белки приобретают устойчивую конформацию, которая определяет их функциональность в организме.
В целом, гидрофобные взаимодействия являются одним из основных факторов, определяющих третичную структуру белка. Они обеспечивают протяженность полипептидной цепи, способствуют формированию важных элементов пространственной конфигурации и обеспечивают устойчивость белковой структуры в различных условиях окружающей среды.
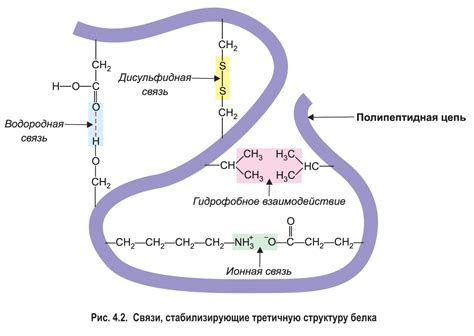
Роль водородных связей в поддержании устойчивости третичной структуры белка
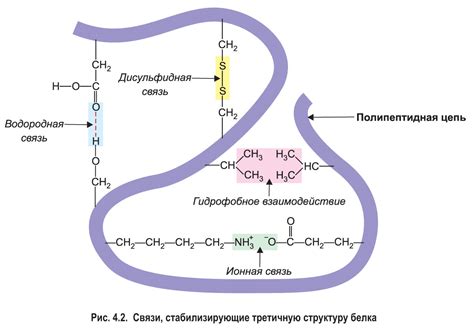
Одним из ключевых механизмов, при котором водородные связи играют существенную роль, является формирование спиралей альфа. Взаимодействие водородных связей между аминокислотными остатками позволяет спираль альфа образовываться в стабильном пространственном конформации. При этом, водородные связи формируются между атомами водорода в аминогруппе и атомами кислорода в карбоксильной группе каждой аминокислоты. Это взаимодействие способствует сохранению протяженной, упакованной и нетерпимой к кручению структуры спирали альфа, что придает белку необходимую прочность и устойчивость.
Водородные связи также играют определенную роль в формировании и стабилизации листа бета. В этом случае, водородные связи образуются между атомами водорода в аминогруппах и атомами кислорода или азота в боковых цепях различных аминокислот. Эти взаимодействия способствуют складыванию листа бета в определенную пространственную структуру, обеспечивающую его устойчивость и прочность.
Таким образом, значение водородных связей в стабилизации третичной структуры белка нельзя преуменьшить. Эти взаимодействия обеспечивают устойчивость и прочность функционально важных элементов структуры белка, что в свою очередь позволяет выполнять его основные функции в клетке. Понимание процессов и механизмов формирования водородных связей в третичной структуре белка имеет важное значение для расширения нашего знания о его структуре и функции и может привести к разработке новых методов в лечении белковых патологий.
Влияние внешних условий на формирование терциарной структуры белков: роль окружающей среды
В данном разделе рассмотрим, как различные внешние условия могут влиять на процесс формирования сложной третичной структуры белка. Окружающая среда, в которой находится белок, играет важную роль в его стабильности и функциональности.
- Влияние температуры: изменения температуры окружающей среды могут вызывать изменения в третичной структуре белка. При повышенных температурах белки могут денатурироваться, то есть терять свою нативную конформацию. Это может приводить к потере их функциональности.
- Влияние pH-уровня: изменения в pH окружающей среды также могут вызывать изменения в третичной структуре белков. Избыточная кислотность или щелочность может нарушать взаимодействия между аминокислотами, что приводит к разрушению нативного состояния белка.
- Влияние растворителя: свойства растворителя, в котором находится белок, могут оказывать существенное влияние на его структуру. Некоторые растворители могут изменять пространственную ориентацию белка и даже способствовать его сворачиванию или разворачиванию.
Таким образом, понимание влияния внешних условий на формирование терциарной структуры белка является важным шагом в изучении его функциональности и возможности контроля над ним в различных условиях. Различные параметры окружающей среды должны быть учтены для эффективного проектирования и использования белковых систем в различных областях науки и промышленности.
Влияние химических элементов на свертывание протеина

Металлические ионы играют важную роль в поддержании стабильности и функциональности протеина. Они могут вступать в координационные связи с атомами аминокислот, что способствует созданию дополнительных связей внутри белковой молекулы. Это может привести к изменению его конформации, а следовательно, к изменению его функции.
Известно, что разные металлические ионы могут оказывать различное влияние на третичную структуру протеина. Например, ионы цинка обеспечивают стабилизацию некоторых ферментов, что позволяет им эффективно катализировать химические реакции в организме. Другие металлические ионы, такие как железо или медь, могут способствовать образованию сложных кластеров, которые участвуют в переносе электронов и синтезе белков.
| Металлический ион | Влияние на протеин |
|---|---|
| Цинк | Стабилизация ферментов |
| Железо | Участие в переносе электронов |
| Медь | Синтез белков |
Таким образом, металлические ионы играют важную роль в формировании третичной структуры протеина и определяют его функциональность. Исследование и понимание влияния этих ионов на свертывание и активность белков является важным шагом в понимании механизмов биохимических процессов, происходящих в организме.
Роль модификаций после синтеза в архитектуре белков
Посттрансляционные модификации выступают важным актером, вносящим команду в изменение структуры белков, они влияют на места взаимодействия с другими молекулами, на активность и стабильность белковой структуры. Данный механизм имеет огромное значение для согласования функций белков в клетке, обеспечивая не только их пространственную организацию, но и контролируя их активность и цикличность.
Выполняя важные функции, посттрансляционные модификации обладают различными механизмами воздействия на структуру белка: добавление химических групп, изменение фосфорилирования и гликозилирования, добавление железа, цинка и других ионов, а также активация или инактивация ферментативных способностей с помощью протеолитических реакций. Учитывая все эти процессы, их целенаправленное взаимодействие представляет важное звено в формировании функциональных деталей белкового строения.
Таким образом, модификации после синтеза играют решающую роль в достижении оптимальных физико-химических свойств белка и обеспечении его участия в клеточных процессах. Этот раздел посвящен обозначению важности и воздействия посттрансляционных модификаций на архитектуру белков, вскрывая их изысканную роль в формировании разностороннего репертуара биологических функций.
Обратная взаимосвязь между формой и функцией биомолекулы

В этом разделе мы рассмотрим роль третичной структуры белка в определении его функции. Белки, которые выполняют различные функции в клетке, имеют уникальные формы, позволяющие им взаимодействовать с другими молекулами и выполнять свои задачи. Исследования последнего десятилетия позволили понять, что третичная структура белка тесно связана с его функцией, и изменения в форме могут влиять на работу белка.
Прежде чем глубже погрузиться в обсуждение этой темы, важно отметить, что белки обладают высокой степенью гибкости и могут принимать разные конформации в зависимости от своего окружения. Однако, основные элементы структуры белка остаются неизменными и определяют его функцию.
Уникальная форма белка обеспечивает определенные химические и физические свойства, которые требуются для его взаимодействия с другими молекулами. Некоторые белки, например, могут быть специализированы для связывания и переноса определенных молекул, таких как кислород или гормоны. Эти белки имеют специфические углубления, выступы или карманы, которые обеспечивают точное сопряжение с целевыми молекулами.
С другой стороны, изменения в третичной структуре белка могут привести к нарушению его функции. Например, генетические мутации или посттрансляционные модификации могут изменить форму белка, что может привести к его неправильной работе или даже потере функции. Понимание связи между структурой и функцией белка позволяет углубить наше знание о биохимических процессах в клетке и может иметь практическое применение в медицине и разработке лекарств.
- Третичная структура белка и ее связь с функцией
- Химические свойства формы белка
- Специализация белков для конкретных взаимодействий
- Нарушение функции белка при изменении его структуры
- Практическое применение понимания связи между структурой и функцией
Вопрос-ответ

Какая роль играет третичная структура белка?
Третичная структура белка определяет его функцию. Она обеспечивает правильное расположение аминокислотных остатков в пространстве, что позволяет белку выполнять свои биологические функции.
Какими процессами формируется третичная структура белка?
Формирование третичной структуры белка происходит за счет взаимодействия аминокислотных остатков, которые связываются друг с другом через различные типы химических связей. Один из ключевых процессов - сворачивание цепочки аминокислот в простой компактный узел.
Какие механизмы определяют формирование третичной структуры белка?
Формирование третичной структуры белка зависит от многих факторов. Одним из главных механизмов является положение заряженных аминокислотных остатков, которые могут взаимодействовать друг с другом электростатическими связями. Также важную роль играют водородные связи, взаимодействия гидрофобных остатков и дисульфидные мостики.
Какие методы используются для изучения третичной структуры белка?
Для изучения третичной структуры белка используются различные методы. Одним из наиболее распространенных является рентгеноструктурный анализ, который позволяет определить точное пространственное расположение атомов в белке. Также используются методы ядерного магнитного резонанса и флуоресцентной спектроскопии.
Может ли изменение третичной структуры белка привести к его денатурации?
Да, изменение третичной структуры белка может привести к его денатурации. Денатурация - это потеря пространственной организации белка, при которой он теряет свою функцию. Это может произойти в результате изменения условий окружающей среды, таких как высокая температура, изменение pH или наличие химических веществ, которые взаимодействуют с белком.
Какие процессы отвечают за формирование третичной структуры белка?
Формирование третичной структуры белка обычно происходит поэтапно. Сначала, после синтеза полипептида, происходит складывание аминокислотных остатков во вторичную структуру - альфа-спираль, бета-складку и другие мотивы. Затем образуются различные связи и взаимодействия между аминокислотами, такие как гидрофобные взаимодействия, электростатические взаимодействия, водородные связи. В результате этих процессов, полипептид принимает определенную пространственную конформацию, составляющую его третичную структуру.