В мире химии существует огромное количество разнообразных веществ и соединений, каждое из которых обладает своими уникальными свойствами и характеристиками. Одним из наиболее интересных и распространенных классов химических соединений являются кислоты и соли.
Кислоты и соли широко используются в различных сферах нашей жизни - от химической промышленности до кулинарии. Они играют важную роль в нашей жизни, участвуя во множестве химических реакций и обеспечивая нам необходимые вещества и продукты.
Однако, несмотря на то, что кислоты и соли могут показаться похожими по своей природе, они имеют ряд существенных различий. Кислоты обладают кислотными свойствами и могут образовывать положительные ионы в растворе, в то время как соли, напротив, образуют отрицательные ионы и обладают щелочными свойствами. Это различие в свойствах обусловлено электронной структурой молекул и ионов данных соединений.
Особенности химических соединений: кислоты и соли

Кислоты и соли отличаются как по своему происхождению, так и по своим химическим свойствам. Кислоты образуются от веществ, содержащих в своей структуре водородные ионы, а их реакция с основаниями приводит к солевому образованию. Соли, в свою очередь, образуются от процессов нейтрализации, их можно получить путем соединения аниона кислоты с катионом основания.
Кислоты и соли обладают различными свойствами, которые определяют их использование и значение в различных областях жизни и промышленности. Например, кислоты обладают кислотностью, которая выражается в реакции с основаниями и способности отдавать протоны. Соли, в свою очередь, обладают кристаллической структурой, растворимостью в воде и способностью образовывать ионные решетки.
Таким образом, кислоты и соли представляют собой два разных класса химических соединений, которые характеризуются различными происхождением и химическими свойствами. Изучение и понимание этих различий позволяет лучше понять и применять их в различных областях науки и технологии.
Атомная структура и состав

Исследование атомной структуры и состава важно для понимания различий между кислотами и солями в химии. Атомы, строительные блоки всех веществ, обладают различными свойствами и взаимодействуют друг с другом, образуя разные химические соединения.
Кислоты и соли - это два основных типа химических соединений. Кислоты содержат в своей структуре один или более водородных атомов, обычно соединенных с кислородом. Они могут быть кислотными соединениями истинного типа или солями кислот.
Кислоты характеризуются кислотными свойствами, такими как кислотность, реакция с основаниями, способность отдавать протон и др. Они состоят из атомов разных элементов, составляющих их структуру, и включают в себя такие химические соединения, как соляная кислота (HCl), серная кислота (H2SO4) и многие другие.
Соли являются результатом реакции кислоты с основанием. В их структуре водородные атомы кислоты заменяются металлическими ионами. Соли не обладают кислотными свойствами. Они могут быть созданы путем нейтрализации кислоты и основания или образования ионных связей между атомами. Примеры солей включают хлорид натрия (NaCl) и сульфат магния (MgSO4).
Реакция с водой и образование ионов

В процессе взаимодействия с водой, как кислоты, так и соли, претерпевают определенные изменения, приводящие к образованию ионов.
Кислоты вступают в реакцию с водой, образуя водородные ионы (H+) и соответствующие анионы. Это происходит благодаря способности кислот свободно отдавать протоны (H+) воде.
Соли также взаимодействуют с водой, однако процесс образования ионов у солей немного отличается. Когда соль растворяется в воде, ее ионные компоненты (катионы и анионы) становятся свободными и перемещаются независимо друг от друга в растворе.
Таким образом, как кислоты, так и соли проявляют активность взаимодействия с водой и образуют ионы, но с различными механизмами этого процесса.
Различия в химических свойствах

В данном разделе будет рассмотрено, как элементы приобретают свои химические свойства и как они влияют на кислоты и соли. Будут рассмотрены особенности и проявления химических реакций, которые происходят с этими веществами в различных условиях.
Уникальные свойства кислот:
1. Кислоты обладают способностью выделять водородные ионы (H+), что проявляется в их кислотности. Это позволяет кислотам проявлять свою активность и растворяться в воде.
2. Кислотные реакции обычно сопровождаются выделением тепла. В результате этого процесса может происходить денатурация белков и разрушение органических веществ.
3. Кислоты могут реагировать с основаниями, образуя соли и воду.
"При реакциях с кислотами образуются кислотные соли."
Уникальные свойства солей:
1. Соли обычно являются кристаллическими соединениями и могут быть различных цветов и физических состояний.
2. Они не обладают кислотными или основными свойствами и могут быть растворимыми или нерастворимыми в воде.
3. Соли могут образовывать ионы, которые иметь различные степени окрашивания, что делает их использование в качестве красителей или пигментов.
"Разнообразные окраски солей являются результатом наличия различных катионов и анионов, участвующих в их структуре."
Кислоты как первичные формы водородных ионов
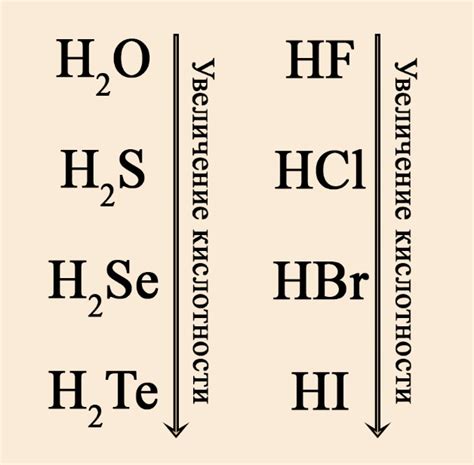
В химической науке существует широкий спектр различных веществ, из которых одни проявляют кислотные свойства, в то время как другие обладают солевыми характеристиками. В данном разделе мы рассмотрим роль кислот в качестве источников водородных ионов и их отличия от солей.
Соли как результат соединения различных элементов

Соли являются основными компонентами многих природных и искусственных соединений. Примером могут служить такие вещества как морская соль, которая содержит соединения натрия и хлора, или поваренная соль, которая, в свою очередь, является хлористым натрием. В химической промышленности также широко используются соли разных металлов и неметаллов для получения различных продуктов, включая лекарственные препараты, красители, удобрения и т.д.
Важно отметить, что соли имеют различные степени растворимости в воде и других растворителях, что влияет на их применение в разных областях науки и промышленности. Кроме того, соли способны образовывать специфические кристаллические структуры, что придает им определенные физические свойства, такие как прозрачность, цветность, твердость и другие.
Таким образом, соли как соединения металлов и неметаллов представляют собой важную группу веществ с множеством применений. Их образование основано на замещении водородных ионов активными элементами, создавая характерные кристаллические структуры с уникальными химическими и физическими свойствами.
Влияние кислот и солей на pH окружающей среды

В данном разделе мы рассмотрим, как взаимодействие кислот и солей может оказывать влияние на кислотно-щелочной баланс окружающей среды.
Кислоты и соли - это два основных типа химических веществ, которые присутствуют в окружающей нас среде. Они имеют различные свойства и реакции, которые могут влиять на pH среды, т. е. на ее кислотно-щелочной баланс.
Кислоты характеризуются своей способностью отдавать протоны (водородные ионы) при реакции с другими веществами. Они могут проявлять кислотные свойства в результате образования положительно заряженных ионов. Такое взаимодействие может приводить к понижению pH среды, делая ее более кислотной.
Соли, в свою очередь, образуются в результате реакции кислот и оснований или нейтрализации. Они представляют собой химические соединения, состоящие из ионов, которые могут взаимодействовать с веществами в окружающей среде. В зависимости от присутствующих ионов, соли могут оказывать как кислотные, так и щелочные свойства.
Между тем, влияние кислот и солей на pH окружающей среды зависит от их концентрации и характера взаимодействия. Некоторые кислоты могут вызывать кислотные дожди и загрязнение водой, что приводит к изменению pH и негативно влияет на биологические системы. Однако, некоторые соли, например, гидрокарбонаты, могут выполнять буферные функции и регулировать pH среды, поддерживая его в оптимальном диапазоне для различных организмов.
Таким образом, понимание взаимодействия кислот и солей с окружающей средой и их влияния на pH является важным аспектом химии и экологии. Это помогает нам лучше понять эффекты, которые данные соединения могут оказывать на биологические системы и в целом на экосистему.
Примеры применения кислот в повседневной жизни

| Область применения | Примеры использования |
|---|---|
| Пищевая промышленность | Кислота лимонная (цитрусовые) используется для добавления кислотности в напитки и пищевые продукты, такие как лимонады, консервы и желе. |
| Медицина | Аскорбиновая кислота (витамин C) используется в качестве добавки к пище и витаминного комплексах для поддержания иммунной системы и профилактики цинги. |
| Косметология | Салициловая кислота применяется в косметических средствах для лечения акне и проблемной кожи. |
| Хозяйственные цели | Уксусная кислота используется для уборки и удаления накипи, а также для приготовления маринадов и консервации продуктов. |
Это лишь некоторые примеры использования кислот в нашей повседневной жизни. Они выполняют различные функции и проявляют свои полезные свойства среди прочего. Благодаря своей универсальности, кислоты стали неотъемлемой частью нашего обыденного существования и имеют широкую популярность в разных отраслях нашей жизни.
Примеры использования солей в различных отраслях промышленности

Соли, химические соединения, получают путем реакции кислот и оснований, и они находят применение в разнообразных отраслях промышленности. Свойства и состав солей определяют их возможности использования в различных производственных процессах и технологиях.
Примеры использования солей в промышленности:
1. Пищевая промышленность: соли широко применяются в производстве пищевых продуктов для придания пикантности, усиления вкуса или как консерванты для сохранения продуктов.
2. Химическая промышленность: соли являются важными компонентами при синтезе различных химических соединений, таких как пластиковые полимеры или лекарственные препараты.
3. Технология углеводородов: соли используются для очистки нефти и газа от примесей, а также для извлечения ценных компонентов.
4. Производство стекла: соли, такие как NaCl (хлорид натрия) или K2CO3 (карбонат калия), применяются для улучшения свойств плавления и формирования стекла.
5. Производство бумаги и текстиля: соли используются для обесцвечивания и отбеливания сырья, а также для фиксации красителей в текстильной промышленности.
6. Медицина: соли, такие как NaCl (хлорид натрия) или MgSO4 (сульфат магния), применяются в медицине для обеспечения электролитного баланса в организме и в процессе лечения некоторых заболеваний.
Это лишь некоторые примеры использования солей в промышленности. Благодаря своим химическим свойствам, соли находят широкое применение в различных отраслях и приводят к производству множества необходимых нам продуктов и материалов.
Роль кислот и солей в химических процессах
- Кислоты – это химические соединения, которые активно реагируют с другими веществами, проникая в их структуру и воздействуя на них. Они способны изменять свойства других веществ, образуя новые соединения и вызывая разнообразные реакции. Это делает их неотъемлемыми компонентами многих химических процессов.
- Соли, в свою очередь, представляют собой результат реакции кислоты и основания. Они обладают структурой, в которой ионы позитивно и негативно заряженные частички электрически связаны друг с другом. Такое связывание приводит к возникновению новых свойств и возможностей веществ, являясь основой для множества химических процессов.
- Роль кислот и солей в химических процессах распространяется на разные области. Они могут служить как катализаторы для ускорения химических реакций, так и управлять буферными системами, поддерживая константность pH в растворах, что крайне важно для жизнедеятельности организмов. Кроме того, кислоты и соли применяются в различных производственных процессах, в технологии пищевой промышленности и в производстве лекарств.
Таким образом, кислоты и соли оказывают значительное влияние на множество химических процессов, играя важную роль в превращении веществ и регулировании различных реакций в мире природы и промышленности.
Потенциальная опасность и меры предосторожности при работе с кислотами и солями

При работе с кислотами и солями необходимо соблюдать несколько ключевых мероприятий для минимизации риска возможных травм или заболеваний. Прежде всего, следует использовать соответствующую защитную экипировку, включая защитные очки или маску, резиновые перчатки и халаты, чтобы предотвратить контакт с кислотами и солями.
- При работе с кислотами настоятельно рекомендуется обеспечить хорошую вентиляцию помещения. Дымы и пары кислот могут быть ядовитыми и вызывать раздражение дыхательных путей.
- Следует избегать случайного попадания кислот и солей на кожу или в глаза. В случае контакта, область немедленно промыть водой в течение нескольких минут.
- Помимо этого, следует также учитывать, что хранение кислот и солей должно осуществляться в специальных контейнерах, обычно из пластика или стекла, с пометкой о их химической природе и соответствующими предупреждающими знаками.
Важно понимать, что кислоты и соли могут быть опасными для здоровья, если не соблюдать правила безопасности. Поэтому обучение и надлежащая подготовка персонала, связанного с работой с этими химическими веществами, являются неотъемлемой частью процесса и должны быть строго соблюдены.
Вопрос-ответ

Чем отличаются кислоты и соли в химии?
Кислоты и соли являются разными классами химических соединений. Кислоты являются соединениями, которые обладают кислотными свойствами и способны отдавать протоны. Соли, в свою очередь, являются соединениями, образованными в результате реакции нейтрализации кислоты и основания. Отличием между кислотами и солями также является то, что соли обладают ионным связыванием, а кислоты могут быть как ионными, так и молекулярными соединениями.
Чем отличаются кислоты и соли по своим физическим свойствам?
Физические свойства кислот и солей имеют ряд отличий. Кислоты обычно имеют острый запах, могут вызывать раздражение или ожоги на коже. Они также могут обладать высокой текучестью и низкими температурами кипения. Соли, в свою очередь, могут быть твёрдыми кристаллическими веществами и обладать хорошей растворимостью в воде и др. растворителях. В отличие от кислот, соли обычно не обладают запахом и не оказывают раздражающего действия.
Какие основные функции выполняют кислоты и соли в химии?
Кислоты выполняют ряд важных функций в химических реакциях и процессах. Они могут служить как катализаторы, участвовать во многих органических синтезах, использоваться в качестве реагентов для получения других соединений и т.д. Соли также имеют широкий спектр применений. Они могут использоваться в пищевой промышленности, медицине, производстве удобрений, производстве стекла, в качестве катализаторов и многом другом.
Чем отличаются кислоты и соли в химии?
Кислоты и соли являются химическими соединениями, но имеют разные свойства и состав. Кислоты обладают кислотными свойствами и содержат в своей структуре один или несколько протонов водорода, которые могут быть переданы другим веществам. Соли, в свою очередь, являются результатом реакции между кислотами и основаниями. Они состоят из положительного и отрицательного ионов, которые образуют кристаллическую структуру. Таким образом, основное отличие между кислотами и солями заключается в свойствах и составе этих химических соединений.