Загадочная и увлекательная наука химия - это путь к пониманию состава и свойств вещества. Ее исследования позволяют нам разгадывать тайны, скрывающиеся за элементами периодической системы. И одним из ключевых понятий, позволяющих нам раскрыть эти тайны, является молярная масса.
Возможно, вы уже сталкивались с этим понятием, но давайте представим, что в нашей химической сокровищнице у нас есть множество инструментов и навыков, которые помогут нам еще глубже понять молярную массу. В этом разделе мы откроем перед вами эту сокровищницу, опишем методы и хитрости, которые приведут вас к окончательному определению молярной массы без необходимости обращаться к таблице элементов.
Когда мы говорим о молярной массе, мы обычно имеем в виду среднюю массу атомов, из которых состоит вещество. Молекулы сами по себе являются сложными структурами, состоящими из атомов разных элементов, и их масса напрямую связана с массами этих атомов. Важно знать, что молярная масса измеряется в граммах на моль (г/моль) и играет важную роль в различных химических расчетах, таких как вычисление количества вещества в химической реакции или определение стехиометрии.
Роль молярной массы и ее значение в химии
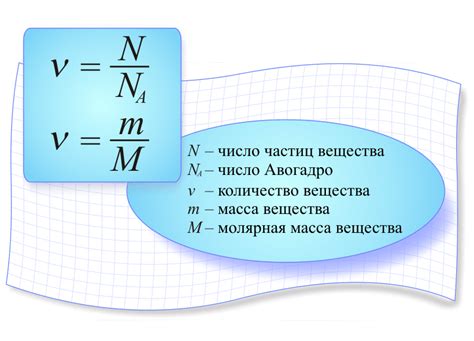
Значение молярной массы состоит в том, что она позволяет химикам проводить расчеты и прогнозировать результаты химических реакций. Зная молярную массу вещества, можно определить его количество в веществе, а также провести расчеты связанные с объемами и концентрациями веществ.
Одним из основных инструментов для определения молярной массы является таблица элементов, в которой перечислены все известные элементы и указаны их атомные массы. Используя эту информацию, химики могут составлять формулы и решать различные задачи, связанные с химическими веществами. В таблице элементов также указываются атомные массы их изотопов, что важно для расчетов соединений содержащих несколько изотопов одного элемента.
| Элемент | Атомная масса |
|---|---|
| Водород (H) | 1 |
| Кислород (O) | 16 |
| Углерод (C) | 12 |
Молярная масса является важным параметром в решении химических задач и играет значительную роль в проведении различных химических реакций и исследований. Расчеты, связанные с молярной массой, позволяют определить количество вещества, производить конверсии между массой проб и количеством вещества, а также проводить прогнозы по результатам химических реакций.
Описание таблицы элементов и ее практическое применение
Одна из полезных особенностей таблицы элементов - ее способность предоставлять информацию о физических и химических свойствах каждого элемента. С помощью таблицы можно найти атомную массу или молярную массу элемента, что является важным показателем при проведении химических расчетов и реакций. Например, для определения молярной массы соединения нужно сложить массы всех атомов в этом соединении с учетом их коэффициентов.
Правильное использование таблицы элементов требует знания ее структуры и основных характеристик. К примеру, нумерация элементов в таблице строится таким образом, что номер элемента также указывает на количество протонов в его ядре. В таблице элементов также можно найти информацию о периодах и группах, которые расположены горизонтально и вертикально соответственно.
- Прочитайте заголовки столбцов. Они могут обозначать атомные номера, атомные массы и химические символы элементов.
- Определите номер элемента, молярную массу или другие необходимые данные.
- Используйте коэффициенты реакций, чтобы расчитать молярную массу соединений.
- Анализируйте свойства и характеристики элементов, чтобы проводить точные химические расчеты.
Использование таблицы элементов может сделать процесс химического анализа более удобным и эффективным. Знание основных принципов ее использования и интерпретации данных позволяет выполнять различные расчеты и исследования с высокой точностью.
Как узнать атомную массу химического элемента в периодической системе
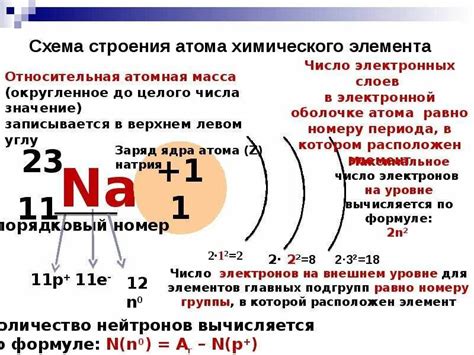
Для нахождения атомной массы элемента в таблице необходимо ориентироваться на среднюю атомную массу данного элемента, которая учитывает присутствие изотопов с различными относительными пропорциями в природе.
Обычно атомная масса элемента указывается в таблице элементов под названием элемента либо в приведенных числовых значениях, либо в виде интервала значений. Чтобы узнать атомную массу конкретного элемента, достаточно найти его символ в таблице и ознакомиться с указанным значением атомной массы.
Запись массы вещества для химических соединений

В данном разделе рассматривается способ представления массы химических соединений, который позволяет определить молярную массу без прямого использования таблицы элементов и учитывает их соотношение в соединении. Этот метод основан на анализе формулы вещества и знаниях о молекулярной структуре соединения.
При записи массы химических соединений данный метод заменяет название элементов, их символы и числа атомов в формуле определенными обозначениями, которые отражают их молекулярную структуру. Это позволяет более компактно и наглядно представить массу вещества.
Для удобства в данном методе используются индексы для обозначения числа атомов каждого элемента в формуле соединения. Также, чтобы избежать повторений одинаковых элементов в формуле, часто применяют скобки для обозначения групп атомов, что упрощает чтение и понимание записи массы соединений.
Преимуществом представления массы химических соединений с использованием данного метода является возможность быстрого и точного определения молярной массы без необходимости просмотра таблицы элементов. Запись массы вещества для химических соединений существенно облегчает проведение расчетов в химических задачах и позволяет легко сравнивать массы различных соединений.
- Пример записи массы вещества для воды: H2O
- Пример записи массы вещества для диоксида углерода: CO2
- Пример записи массы вещества для глюкозы: C6H12O6
Пример расчета молярной массы простого вещества

Для примера возьмем молекулу водорода, которая состоит из двух атомов. Масса атома водорода равна примерно 1,008 г/моль. Итак, мы знаем, что молекула водорода состоит из двух атомов, а масса одного атома водорода равна 1,008 г/моль.
Для расчета молярной массы простого вещества водорода умножаем массу одного атома на количество атомов в молекуле: 1,008 г/моль * 2 атома = 2,016 г/моль. Таким образом, молярная масса водорода равна 2,016 г/моль.
Аналогичным образом можно расчитать молярную массу других простых веществ, зная массы атомов, их количество в молекуле, и применяя указанные выше формулы.
Расчет молярной массы сложного соединения: основные принципы

Однако, при расчете молярной массы сложных соединений, таких как органические соединения или полимеры, необходимо учитывать дополнительные переменные. В основе расчета лежит принцип, согласно которому количество каждого элемента в соединении умножается на его атомную массу, а затем суммируется для получения общей массы. Однако, для учета веществ, которые имеют разные изотопы или существуют в различных конформациях, требуется дополнительная информация и действия.
- Определите молекулярную формулу сложного соединения, учитывая подробную структуру и последовательность атомов.
- Используя таблицу элементов, найдите атомную массу каждого элемента, входящего в состав соединения.
- Установите, есть ли вещества с разными изотопами. Если да, учтите процентное содержание каждого изотопа и его атомную массу при расчете молярной массы.
- Если вещество существует в различных конформациях или изомерах, установите их пропорции и атомные массы.
- После определения массы каждого элемента умножьте его на количество атомов в молекуле соединения.
- Сложите полученные значения, чтобы получить общую массу всех элементов в молекуле.
Правильный расчет молярной массы сложного соединения позволяет более точно проводить химические расчеты и исследовать его физико-химические свойства. Навык определения молярной массы является фундаментальным в химической науке и применим в различных областях, включая аналитическую химию, синтез и фармацевтику.
Влияние изотопического состава на расчет атомных масс элементов

Изотопы играют значительную роль в определении молярной массы элементов. Изучение изотопного состава элементов позволяет получить более точные данные при расчете молярной массы, учитывая вариативность массы атомов в природе.
Изотопы – это атомы одного и того же элемента, имеющие одинаковое количество протонов, но разное количество нейтронов в ядре. Отличительной особенностью изотопов является различие их атомных масс. Это вариативность атомных масс позволяет учитывать изотопический состав элементов при расчете молярной массы.
При расчете молярной массы элемента используются средние значения массы его атомов. Эти значения учитывают вклад каждого изотопа, встречающегося в природе, пропорционально его изотопической обилии. Таким образом, если изотопы имеют разную атомную массу и/или разное количество встречаемости, молярная масса элемента будет отличаться от своего номинального значения.
- Изотопический состав элементов
- Массовый процент изотопа
- Расчет средней массы атома
- Расчет молярной массы элемента
- Точность и вариативность молярной массы
Использование молярной массы в расчетах химических реакций

Знание молярной массы позволяет химикам проводить различные расчеты, такие как определение количества вещества, массы или объема для реакций. Она также помогает в определении соотношения между различными элементами в химической формуле и позволяет прогнозировать химические свойства веществ.
Для использования молярной массы в расчетах, важно знать таблицу элементов, где указаны массовые числа их атомов. Таким образом, когда известна химическая формула вещества, можно определить массу молекулы, исходя из молей вещества.
Для удобства использования, таблица элементов организована по возрастанию атомного номера, а также группируется по химическим свойствам. Это позволяет легко найти нужные значения молярной массы для расчетов.
- С помощью молярной массы можно определить количество вещества, используемого или образующегося в реакции. Это особенно полезно при проведении экспериментов или разработке новых химических процессов.
- Молярная масса также позволяет определить массу вещества, которая требуется для достижения определенной реакции. Это важно при проектировании производства химических соединений или оптимизации процессов.
- Кроме того, молярная масса позволяет определить объем газовых веществ при заданных условиях, что необходимо для управления процессами, связанными с газообразными реакционными средами.
Использование молярной массы в химических расчетах является неотъемлемой частью работы химиков. Этот инструмент позволяет проводить точные и надежные расчеты, что важно для понимания и контроля химических процессов в различных областях науки и промышленности.
Применение знания о молярной массе в практических задачах

Одним из практических применений знания о молярной массе является расчет количества вещества. Зная молярную массу элемента или соединения можно определить количество вещества, используемое в реакции или имеющееся в реакционной смеси. Это позволяет точно определить пропорции компонентов и следовать рецепту или экспериментальным условиям.
Большое значение имеет также использование знания о молярной массе при проведении химических анализов. Массовые проценты элементов в соединении могут быть определены исходя из их взаимных пропорций и молярной массы. Это помогает химикам определить качественный и количественный состав образцов и идентифицировать неизвестные соединения.
Еще одним важным аспектом применения знаний о молярной массе является расчет объемов газов. Зная количество вещества и молярную массу газа, можно рассчитать его объем при определенных температуре и давлении. Это имеет большое значение при проведении газовых реакций, а также в газовой хроматографии и других аналитических методах.
| Применение | Описание |
|---|---|
| Расчет количества вещества | Определение пропорций компонентов в реакции |
| Анализ состава образцов | Определение массовых процентов элементов |
| Расчет объемов газов | Определение объема газа при определенных условиях |
Вопрос-ответ

Как определить молярную массу вещества по таблице элементов?
Для определения молярной массы вещества по таблице элементов необходимо знать химический состав данного вещества. Молярная масса вычисляется путем суммирования атомных масс всех элементов, входящих в состав вещества, умноженных на их стехиометрические коэффициенты в реакции. На таблице элементов можно найти атомные массы всех известных элементов, которые указаны в единицах г/моль. После вычисления суммы атомных масс всех элементов, получается молярная масса вещества в г/моль.
Какие данные необходимы для определения молярной массы по таблице элементов?
Для определения молярной массы по таблице элементов необходимо знать состав вещества, то есть какие элементы входят в его состав, а также их стехиометрические коэффициенты в реакции. Также необходимо иметь доступ к таблице элементов, где указаны атомные массы всех известных элементов.
Есть ли специальная формула или алгоритм для определения молярной массы по таблице элементов?
Для определения молярной массы по таблице элементов используется простой алгоритм. Необходимо сложить все атомные массы элементов, входящих в состав вещества, умноженные на их стехиометрические коэффициенты. Полученная сумма будет являться молярной массой вещества.
Можно ли определить молярную массу вещества без использования таблицы элементов?
Определить молярную массу вещества без использования таблицы элементов можно только в случаях, когда известны атомные массы элементов и их процентное содержание в веществе. В таком случае можно воспользоваться формулой для расчета средней молярной массы: