Одно из фундаментальных понятий в науке - природа материи. Каждое вещество, будь то вода, камень или воздух, состоит из молекул - мельчайших частиц, которые являются основой для строительства мира вокруг нас. И хотя весь мир наполнен различными составленными из молекул объектами, интересно задуматься, какова природа этих молекул и как они взаимодействуют друг с другом.
На протяжении долгого времени ученые обсуждали два существенно различных подхода к пониманию молекул в веществе. Некоторые исследователи проводят аналогии между движением молекул и неорганизованными структурами - воспринимая их аналогично каплям дождя, листьям или рудникам. Другие же исследователи рассматривают молекулы как некие составные частицы, которые постоянно движутся и изменяют свою позицию в пространстве.
Итак, существует ли динамичное движение в мире молекул, или же мы имеем дело с относительно неподвижными структурами? Всеобщая истина в этом вопросе пока не установлена, и в настоящее время ученые продолжают бороться за преобладание одной из двух концепций. Произведенные исследования и оригинальные элементы доказательства позволяют двигаться вперед в понимании природы молекул и того, как они формируют составные части газообразных объектов.
Динамика молекул газа: постоянная скорость или хаотическое пульсирование?

В этом разделе рассмотрим движение молекул газа и их поведение в контексте постоянной скорости и хаотического пульсирования. Молекулы газа в постоянном движении образуют непрерывный поток, подчиняясь определенным законам и взаимодействию с окружающими частицами. С другой стороны, молекулы газа также может именоваться как мельчайшие элементы, совершающие непредсказуемые перемещения и меняющие свою скорость и направление с большой частотой.
Если мы принимаем предположение о постоянной скорости молекул газа, то можно сказать, что они движутся равномерно и упорядочено, что создает статическую структуру. Однако, если мы принимаем во внимание модель хаотического пульсирования, то молекулы газа представляют собой режим нерегулярного движения, их движение описывается как непредсказуемое.
Существует несколько факторов, которые влияют на поведение молекул газа. Это температура, давление и объем. При изменении этих параметров, движение молекул может менять свою природу. Например, при повышении температуры, скорость молекул газа увеличивается, что приводит к более хаотическому движению и возможности проникновения через некоторые структуры.
Важно отметить, что различные типы газов имеют разные особенности движения и взаимодействия молекул. Некоторые газы могут проявлять большую степень хаотичности, в то время как другие могут быть более упорядочены.
Итак, ответ на вопрос о том, является ли движение молекул газа постоянной скоростью или хаотическим пульсированием, заключается в том, что оно может быть и тем, и другим, в зависимости от условий и свойств самого газа.
Учение о движении молекул и основные законы кинетической теории газов

История кинетической теории газов начинается с запутанных вопросов о сущности и поведении газов в пространстве. Но благодаря тщательному экспериментальному и теоретическому исследованию, ученые смогли сформулировать основные принципы этой науки. Одним из ключевых постулатов является предположение о том, что газ состоит из невидимых, неподатливых и невзаимодействующих частиц, называемых молекулами.
Кинетическая теория газов утверждает, что движение молекул является основным фактором, обуславливающим характеристики газа. Она изучает как коллективное поведение газа в целом, так и поведение отдельных молекул внутри газовой среды. Эта теория описывает, как молекулы взаимодействуют друг с другом и со стенками сосуда, в котором содержится газ.
Одним из основных принципов кинетической теории является утверждение о том, что молекулы газа находятся в непрерывном движении. В то время как некоторые молекулы свободно и беспорядочно перемещаются, другие могут сталкиваться и взаимодействовать. Эти столкновения обуславливают основные свойства газов, такие как давление, объем и температуру.
Еще одним важным принципом кинетической теории является утверждение о том, что кинетическая энергия молекул прямо связана с их температурой. Чем выше температура газа, тем больше кинетическая энергия молекул, что приводит к более интенсивному движению и более сильным столкновениям.
Феномен нагревания и охлаждения: основы статической структуры газа
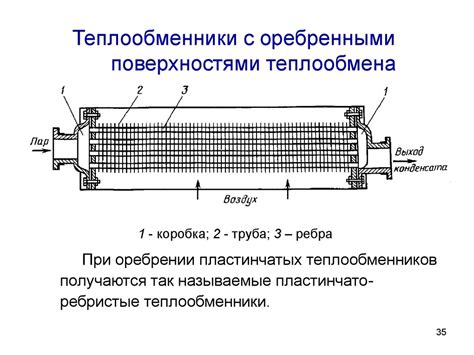
Рассмотрим явление, которое происходит с газом, когда он нагревается или охлаждается. Понимание этого процесса требует переосмысливания установившихся представлений о молекулах в газовой среде и движении внутри нее. Вместо рассмотрения газа как набора свободно движущихся частиц, посмотрим на него как на структуру, в которой эти частицы могут образовывать устойчивые формы.
Упражняясь в воображении, представим, что газовые молекулы могут на короткое время собираться в определенные группы или образовывать сетку, которая обладает устойчивостью и совокупностью особенных свойств. Эти структуры могут быть неоднородными, иметь разные формы и размеры, и взаимодействовать между собой.
- Среди таких структур можно выделить области повышенной концентрации молекул, которые называются "тепловыми островами". Здесь молекулы сгруппированы ближе друг к другу, образуя связанные цепочки или скопления. Именно в этих областях происходит основной процесс нагревания и охлаждения газа.
- Кроме тепловых островов, в статической структуре газа могут существовать области, где молекулы находятся на достаточном расстоянии друг от друга и не взаимодействуют значительно. Эти области называются "холодными пустынями". Они обладают сниженной плотностью и являются местами, где происходит процесс охлаждения газа.
Таким образом, статическая структура газа является ключевым аспектом объяснения феномена нагревания и охлаждения. Когда газ нагревается, молекулы активно двигаются, образуя тепловые острова, которые равномерно нагревают окружающую среду. При охлаждении же, молекулы замедляют свое движение и переходят в состояние "холодных пустынь", что приводит к снижению температуры. Понимание этой статической структуры глубже помогает объяснить различные физические явления, связанные с газом, и может быть полезным для разработки новых технологий и улучшения способов контроля теплового равновесия.
Взаимосвязь молекулярного строения газов и процесса теплообмена
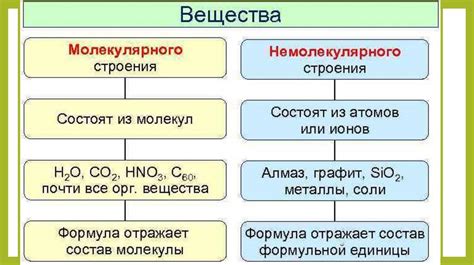
Молекулы газа, которые можно также назвать элементами его микроструктуры, обладают своеобразным взаимодействием друг с другом и со средой. Эта взаимосвязь подразумевает существование сложных энергетических обменов между молекулами газов и окружающей средой. Однако, различные газы обладают разным строением и взаимодействиями молекул, что приводит к различиям в их свойствах и способности обмениваться теплом.
Важную роль в теплообменном процессе играет и количество молекул в единице объема газа. Плотность молекул определяет степень их взаимодействия, что влияет на эффективность передачи энергии в результате теплообмена. Кроме того, молекулярная структура газа напрямую связана с его теплоемкостью, т.е. способностью поглощать и отдавать тепло.
Таким образом, понимание молекулярного строения газов и его влияния на тепловой обмен с окружающей средой позволяет объяснить множество физических явлений, связанных с тепло. Изучение данной темы имеет важное практическое значение, так как позволяет более точно предсказывать и контролировать процессы теплового обмена, а также оптимизировать энергетические системы и устройства, основанные на использовании газовых сред.
Статистический подход к изучению газов: вероятность взаимодействия молекул

Вероятность взаимодействия молекул в газе описывает шансы на то, что две или более молекулы сблизятся настолько близко, чтобы произошло взаимодействие. Это взаимодействие может быть различным в зависимости от типа газа и условий, в которых он находится.
Чтобы рассчитать вероятность взаимодействия молекул, учитываются различные факторы, такие как концентрация газа, его температура, давление и другие параметры. Используя статистические методы, можно определить вероятность встречи молекул, учитывая их случайное движение и распределение в пространстве.
Например, высокая концентрация газа и низкая температура могут повысить вероятность взаимодействия молекул, так как большое количество молекул будет находиться на относительно небольшой площади, и скорость их движения будет невелика.
С другой стороны, низкая концентрация и высокая температура могут снизить вероятность взаимодействия молекул, так как молекулы будут распределены по большей площади и их скорости будут высокими, что делает сближение маловероятным.
Использование статистического подхода позволяет установить основные закономерности и тенденции взаимодействия молекул газа. Это позволяет нам лучше понять и объяснить различные явления, связанные с данными веществами и использовать эту информацию для различных практических целей.
Статистическая механика и молекулярная хаотичность в объяснении газовых законов

В данном разделе мы рассмотрим подход к объяснению газовых законов, основанный на статистической механике и концепции молекулярной хаотичности. Мы попытаемся понять, каким образом свойства газовых систем, такие как давление, объем и температура, могут быть объяснены с использованием статистических закономерностей и движениями и взаимодействиями молекул газа.
Согласно статистической механике, газовая система состоит из огромного числа частиц - молекул, которые находятся в постоянном хаотическом движении. При этом каждая молекула проделывает множество столкновений и взаимодействий с другими молекулами, стенками сосуда и внешней средой.
Основываясь на этом представлении, газовые законы, такие как закон Бойля-Мариотта, закон Шарля и закон Гей-Люссака, могут быть объяснены через средние значения физических параметров и статистические закономерности коллективного движения частиц. Например, закон Бойля-Мариотта, утверждающий, что при постоянной температуре объем газа обратно пропорционален его давлению, может быть объяснен через коллективное взаимодействие молекул и их столкновения с поверхностью сосуда.
| Статистическая механика и молекулярная хаотичность | объясняют газовые законы |
| Молекулы в газе находятся в постоянном движении и взаимодействуют друг с другом | Законы, такие как закон Бойля-Мариотта, могут быть объяснены через коллективное взаимодействие молекул и их столкновения с поверхностью сосуда |
| Молекулярная хаотичность и статистические закономерности | Позволяют объяснить изменения давления, объема и температуры газовых систем |
Вопрос-ответ

Что такое молекулы газа?
Молекулы газа - это мельчайшие частицы, из которых состоит газ. Они образуют газовую среду и постоянно находятся в движении.
Какова природа движения молекул газа?
Движение молекул газа обусловлено их тепловой энергией. Молекулы постоянно колеблются, вращаются и перемещаются в разных направлениях со случайными скоростями.
Можно ли считать молекулы газа статическими структурами?
Нет, молекулы газа не являются статическими структурами. Они находятся в постоянном движении, взаимодействуют друг с другом и с окружающими их поверхностями.
Влияет ли тепловое движение молекул на свойства газа?
Да, тепловое движение молекул газа существенно влияет на его свойства, такие как объем, давление и температура. Изменение скорости и направления движения молекул приводит к изменению свойств газа.
Может ли газ обладать статическими структурами?
Если газ находится под воздействием внешних факторов, например, находится в замкнутом сосуде или под действием электромагнитного поля, то молекулы газа могут организовываться в более статические структуры, например, образуя кластеры или кристаллические упорядоченные области.