В сфере химических элементов существует группа веществ, которые привлекают к себе внимание ученых своей особенной природой. Одним из самых удивительных соединений является металл, чей окислительный статус равен шести. Это соединение выделяется на фоне прочих элементов своей необычной реактивностью, которая остается загадкой для исследователей.
Такое вещество, обладающее высокой активностью и способностью образовывать окислительные соединения, привлекает внимание ученых, которые стремятся понять его уникальные свойства. Оно обладает способностью взаимодействовать с другими веществами и образовывать соединения, котоые уступают лишь по сложности построения аллотропии углерода.
Исследователи со всего мира пытаются разгадать секрет этого металла, и найти его применение в новых областях науки и технологий. Ведь если мы сможем полностью раскрыть потенциал этого элемента, то сможем открыть новую перспективу в промышленности и сфере инноваций.
Аномалии активности железа при окислении 6: причины и последствия

В данном разделе рассмотрим интересные аспекты активности железа при окислении 6, которые вызывают некоторые необычные явления и требуют дополнительного изучения. Результаты исследований позволяют нам лучше понять, почему такие аномалии возникают и как они могут повлиять на окружающую среду и промышленные процессы.
Одна из причин необычной реактивности железа с окислением 6 может быть связана с его молекулярной структурой. Возможно, наличие специфических химических связей или группировок в структуре железа делает его более активным в реакциях окисления. Такие особенности могут создавать условия для возникновения непредсказуемых и сложных химических реакций.
Другой потенциальной причиной аномалий реактивности железа может быть его взаимодействие с окружающей средой. Например, присутствие определенных кислот или оснований может изменить окислительно-восстановительные свойства железа, ведя к появлению необычного поведения. Также важным фактором может быть температура окружающей среды, которая может прямо или косвенно влиять на активность железа.
Аномалии реактивности железа с окислением 6 имеют разнообразные последствия и могут оказывать влияние на различные области жизни. Например, в промышленности эти аномалии могут приводить к неожиданным нарушениям в процессе производства и снижению качества продукции. Кроме того, в природной среде аномальная активность железа может привести к негативным последствиям, таким как загрязнение водоёмов или повреждение экосистемы.
- Обсуждение молекулярной структуры железа и связи с аномалиями активности
- Влияние окружающей среды на реактивность железа
- Последствия аномалий реактивности железа для промышленности
- Воздействие аномальной активности железа на природную среду
Изучение механизмов реакций железа с окислением 6

Раздел посвящен исследованию процессов взаимодействия железа с окислением 6+ и пониманию их механизмов. В ходе исследований изучаются особенности реакций, происходящих при наличии железа в шестивалентном окисленном состоянии, а также их связь с реактивностью данного химического элемента.
Важным аспектом изучения является поиск синонимов для понятий "железо", "окисление", "загадка" и "реактивность", чтобы представить информацию более разнообразно и избежать повторений.
- Взаимодействие металла с высоким окислительным потенциалом
- Исследование окислительного процесса внутри клеток
- Роль активных центров в молекулах с шестивалентным железом
- Влияние окружающей среды на химические реакции
В данном разделе будут рассмотрены различные аспекты взаимодействия железа с окислением 6, а также приведены примеры основных реакций их механизмов. Исследования в данной области позволяют расширить понимание процессов, происходящих в организмах, и найти применение для данной реактивности в различных областях науки и технологии.
Факторы, оказывающие влияние на активность соединений железа с шестивалентным окислением

Железо, прекрасно знакомое нам как важный элемент окружающего мира, кроет в себе множество загадок, особенно когда речь заходит о его реактивности в соединениях с окислением 6. На самом деле, активность и реакции таких соединений железа могут быть сильно варьировать в зависимости от различных факторов, которые определяют их способность взаимодействовать с другими веществами.
Структурные особенности
Одним из ключевых факторов, влияющих на активность соединений железа с окислением 6, являются их структурные особенности. Степень организации молекулы, расположение атомов в пространстве, присутствие функциональных групп - все это влияет на возможность соединения вступать в реакцию с другими веществами. Некоторые синтезированные соединения железа могут обладать более высокой активностью благодаря определенным структурным особенностям, что делает их особенно интересными для исследователей и применения в различных областях.
Электронные свойства
Электронные свойства соединений железа с окислением 6 влияют на их способность участвовать в химических реакциях. Количество электронов, занимающих определенные энергетические уровни, определяет возможность соединения вступать во взаимодействие с другими веществами и изменять свою окружающую среду. Электронные свойства соединений железа могут быть изменены путем введения различных заместителей или изменения условий окружающей среды, что сделает их более или менее реактивными.
Интермолекулярные взаимодействия
Интермолекулярные взаимодействия играют важную роль в реактивности соединений железа с окислением 6. Они определяют возможность молекулы соединения вступать во взаимодействие с другими молекулами и образовывать новые связи. Величина и характер этих взаимодействий, такие как ван-дер-ваальсовы силы, водородные связи, ионные и ковалентные связи, могут быть изменены различными способами, что повлияет на активность соединения и его реакционную способность.
Таким образом, факторы, влияющие на реактивность соединений железа с окислением 6, включают их структурные особенности, электронные свойства и интермолекулярные взаимодействия. Понимание этих факторов может помочь не только в науке, но и в различных применениях железа и его соединений в различных отраслях. Исследования в этой области продолжаются, и новые открытия могут привести к развитию более эффективных и инновационных материалов и процессов.
Ключевой компонент взаимодействий кислородного обмена: роль железа Fe(VI)
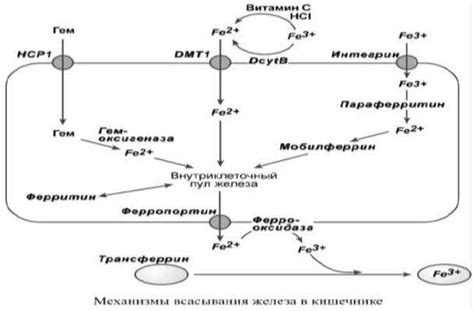
Этот феррооксид с повышенной степенью окисления обеспечивает эффективную передачу энергии и активно участвует в процессах окисления органических соединений. Взаимодействие железа Fe(VI) с различными субстратами позволяет ускорить метаболические реакции и повысить их эффективность в сравнении существующими альтернативными механизмами.
- Ферментативная активность железа Fe(VI) обеспечивает быструю окислительную фазу ряда биохимических путей, таких как аэробное дыхание и гликолиз.
- Химические свойства Fe(VI) позволяют ему играть роль восстановителя, обеспечивая редокс-реакции и генерацию важных электронов, необходимых для синтеза энергии.
- Взаимодействие субстратов с железом Fe(VI) способствует синтезу витаминов и других биологически активных соединений, необходимых для поддержания здоровья и нормального функционирования организма.
Таким образом, понимание роли железа Fe(VI) в окислительном метаболизме является ключевым для расшифровки загадки реактивности и эффективности этих процессов. Дальнейшие исследования данного компонента позволят расширить наши знания о биохимических процессах организма и могут иметь важное значение для разработки новых лекарственных препаратов и методов лечения различных заболеваний.
Вопрос-ответ

Какова реактивность железа с окислением 6 в химических реакциях?
Железо с окислением 6 обладает высокой реактивностью в химических реакциях. Оно может вступать во взаимодействие с различными веществами, проявляя свои окислительные свойства. Реакции с железом 6 часто протекают быстро и энергично.
Чем объясняется загадка реактивности железа с окислением 6?
Загадка реактивности железа с окислением 6 объясняется его электронной структурой. Такое окисление железа соответствует наличию пяти неспаренных d-электронов в его внешнем электронном слое. Это делает его атом очень неустойчивым и способным к активному взаимодействию с другими веществами.
Какие реакции могут осуществляться с участием железа 6?
Железо с окислением 6 может претерпевать разнообразные реакции, включая окислительные, восстановительные и спаривающие реакции. Например, оно может окислять другие вещества, восстанавливаться до более низкой степени окисления или образовывать посложные соединения с другими элементами.
Какое значение имеет реактивность железа с окислением 6 в промышленности и научных исследованиях?
Реактивность железа с окислением 6 имеет огромное значение в промышленности и научных исследованиях. Оно позволяет использовать железо 6 как катализатор или окислитель в различных процессах, таких как синтез органических соединений или очистка промышленных сточных вод. Кроме того, изучение реакции железа 6 с другими веществами помогает расширить наши знания о химических свойствах элементов и улучшить процессы производства в разных отраслях промышленности.