Внимание! Вы только что открыли дверь в захватывающий мир химии, полный удивительных открытий и неожиданных закономерностей. Приветствую вас перед стенами виртуального Дому Химии, где берут начало увлекательные исследования по теме "Таблица Менделеева: расположение элементов и их свойства". Ответы на самые горячие вопросы лежат на тонких полосках органических и неорганических веществ, которые объединены в симметричные паттерны нашей загадочной таблицы.
Каким образом крошечные частицы, нам безжалостно скрывающие свою природу, причастны к созданию всего сущего? Как же им удается по-разному взаимодействовать между собой и обладать уникальными свойствами? Эти вопросы стремительно влетают в мозг, заставляя его волноваться и искать ответы, какой-то закономерности среди фрагментов разбросанных по всей таблице.
Идея, заложенная в структуре таблицы Менделеева, столь гениальна и масштабна, что не может не вызывать восхищение и резко желание поскорее расшифровать каждый её атомистический код. Итак, дамы и господа, предлагаем вам окунуться в это путешествие по недрах элементов, где вы найдете все ответы и раскроете все секреты прекрасного и удивительного мира химических соединений.
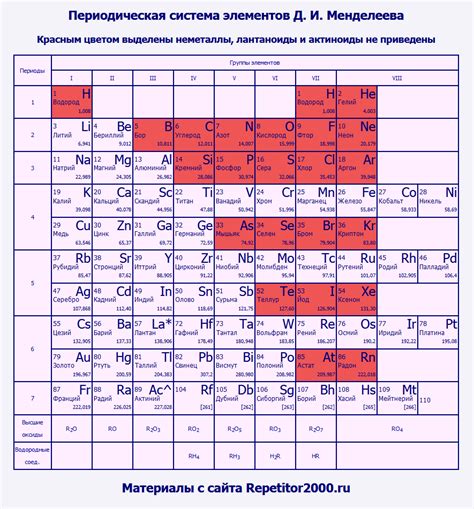
Общая структура таблицы Менделеева: организация элементов по категориям
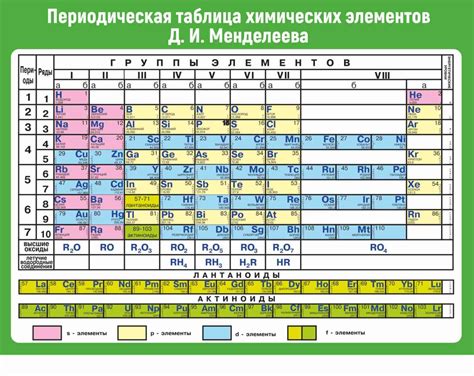
В представленном разделе мы рассмотрим общую структуру таблицы Менделеева и способ, с помощью которого элементы организованы в этом важном справочнике химических элементов. Заглянув в таблицу, мы видим упорядоченное распределение элементов, которое позволяет систематизировать их свойства, классифицировать и определить их взаимосвязи.
Все элементы распределены по горизонталям и вертикалям в таблице Менделеева, создавая уникальные категории. Каждая горизонтальная строка представляет собой период, а вертикальный столбец - группу элементов.
При анализе структуры таблицы Менделеева необходимо обратить внимание на особенности периодов и групп. Периоды отображают последовательность по возрастанию атомных номеров элементов от левого верхнего угла таблицы до правого нижнего угла. В свою очередь, группы объединяют элементы с схожими характеристиками, свойствами и часто обладают подобными внешними электронными оболочками.
Кроме основной структуры, в таблице Менделеева можно заметить несколько дополнительных элементов. Некоторые горизонтальные или вертикальные связи между элементами отображают свойства, явления и закономерности химической реактивности и взаимодействия.
- Периодическая система элементов отражает разнообразие и уникальность химических элементов, их свойства и взаимосвязи.
- Структура таблицы Менделеева организована с помощью периодов и групп элементов.
- Периоды представляют собой горизонтальные строки, а группы - вертикальные столбцы.
- Группы объединяют элементы с схожими характеристиками и свойствами.
- Дополнительные связи в таблице Менделеева отображают закономерности в реактивности и взаимодействии элементов.
Основные компоненты периодической системы и их группировка
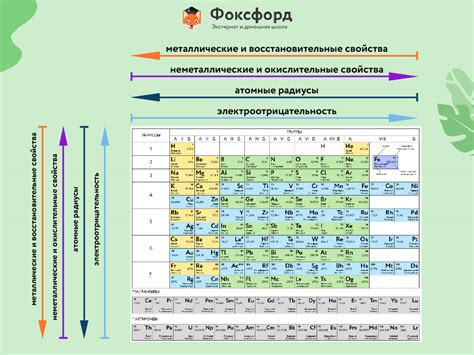
Решительная глава дарованных допользователю страничек апреля «охарактеризует» специфические вещицы химической таблицы и разделит их по группам в соответствии с их общими свойствами.
Металлы: Часть элементов, обладающих характерной металлической структурой, легко проводят ток и тепло. Зачастую, металлы характеризуются блеском и подвержены окислению при воздействии внешних условий.
Неметаллы: Определенная группа элементов, являющихся впечатлительной противоположностью металлам. Неметаллы обладают непроводящими свойствами и не проявляют блеск. Их электронная структура отличается от металлов, включая существенную разницу в потенциале ионизации и электроотрицательности.
Полуметаллы: Элементы, которые находятся на границе между металлами и неметаллами. Их свойства и химическое поведение часто определяются их полосатой электронной структурой.
Группы элементов: Систематическое расположение элементов в периодической таблице Менделеева позволяет их группировать по общим свойствам и химическому поведению. Каждая вертикальная группа представляет собой семейство элементов с похожими химическими свойствами, лежащими в одной электронной оболочке. Это упрощает анализ и предсказание свойств новых элементов и облегчает понимание химических переходов и реакций в периодической системе.
Периоды в таблице Менделеева: особенности распределения химических элементов
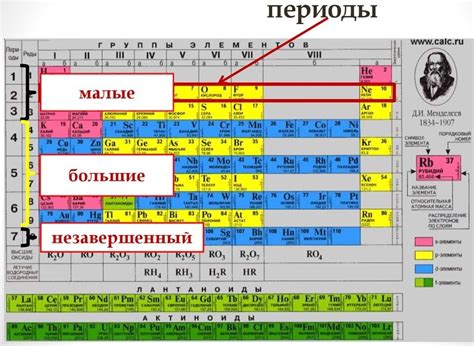
В таблице Менделеева, являющейся основой современной химии, элементы распределены по периодам, которые представляют собой горизонтальные строки. Каждый период имеет свои особенности, определяющие положение элементов в таблице и связанные с их электронной структурой и химическими свойствами.
Первый период состоит из двух элементов - водорода и гелия. Они имеют особую электронную конфигурацию, отличающуюся от других элементов, что объясняет их отдельное размещение в таблице.
Второй период включает восемь элементов, начиная с лития и заканчивая неоном. Эти элементы обладают атомами, у которых электронная оболочка заполняется по принципу октаэдра, что дает им сходные химические свойства. Однако, с каждым последующим элементом, оболочка заполняется на один электрон больше, что отражается в изменении свойств.
Третий и последующие периоды имеют более сложную структуру из-за увеличения количества электронов в оболочке. С этим связано изменение электронной конфигурации и химических свойств элементов, расположенных в этих периодах.
- Некоторые периоды имеют блоки d- и f-элементов, которые считаются переходными металлами и имеют особые свойства.
- Периоды также различаются по количеству элементов: второй период содержит восемь элементов, третий и четвертый - по восемнадцать, пятый - двадцать, а последующие периоды могут содержать до тринадцати элементов.
- Каждый период имеет элемент, являющийся представителем благородных газов. Эти элементы отличаются от остальных химических элементов, их атомы имеют полностью заполненные электронные оболочки.
Периоды в таблице Менделеева являются удобным способом классификации элементов и позволяют увидеть закономерности в их химическом поведении. Изучение особенностей распределения элементов в периодах помогает понять электронную структуру атомов и предсказать их свойства.
Семьи элементов в таблице Менделеева и их характерные свойства
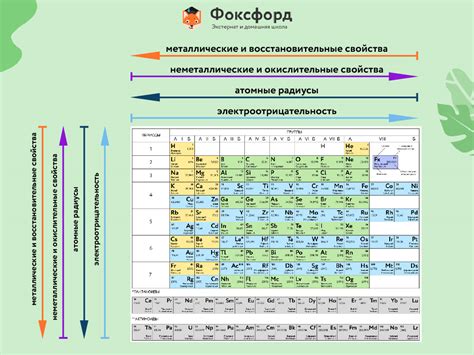
Проанализировав таблицу Менделеева, можно увидеть, что все химические элементы представлены в определенных группах, называемых также семьями. Каждая семья обладает своими характерными свойствами и способностями, которые определяют их поведение в химических реакциях.
Например, первая семья элементов, также известная как щелочные металлы, характеризуется высокой реакционной способностью и мягкостью. Они обладают низкой плотностью и низкой температурой плавления, а также активно взаимодействуют с водой, образуя щелочные растворы.
Вторая семья элементов, или щелочноземельные металлы, также обладает высокой реакционной способностью, однако они менее активны, по сравнению с щелочными металлами. Щелочноземельные металлы образуют ионы с двумя положительными зарядами и активно участвуют в различных химических реакциях.
Третья семья элементов, называемая также семьей бора, имеет свою особенность в том, что у ее элементов есть одинаковое количество электронов во внешней оболочке. Это делает их более устойчивыми и менее реакционноспособными по сравнению с предыдущими двумя семьями.
Зная основные свойства и особенности каждой семьи элементов в таблице Менделеева, можно делать предположения о том, как они будут взаимодействовать с другими веществами и какие соединения они могут образовывать.
Транзиционные металлы: особенности и значение в контексте таблицы Менделеева
Транзиционные металлы обладают рядом характерных свойств, что делает их уникальными в периодической системе. Они включают в себя металлы, которые имеют способность образовывать ионы разных зарядов, образуя комплексные соединения и ставшие широко известными окислительно-восстановительные свойства. Благодаря своей структуре и комплексообразующим способностям, транзиционные металлы обладают свойствами катализаторов, играющих значительную роль в химических процессах.
Важным аспектом изучения транзиционных металлов является их расположение в таблице Менделеева. Они представлены в центральном блоке, который находится между металлами главной подгруппы и элементами второго периода. Это расположение указывает на их промежуточное положение в химических реакциях и структуре атома. Кроме того, уникальные свойства транзиционных металлов обусловлены их электронной конфигурацией, что позволяет им образовывать различные типы связей с другими элементами и обладать разнообразными физическими и химическими свойствами.
Исследования и практическое использование свойств транзиционных металлов являются важным направлением в научных исследованиях. Они применяются в качестве катализаторов в производстве химических веществ, энергетической отрасли, электронной промышленности, а также играют ключевую роль в биохимии и фармакологии. Поэтому понимание особенностей и значения транзиционных металлов имеет существенное значение для развития науки и технологий в различных областях человеческой деятельности.
Вопрос-ответ

Какие элементы содержит таблица Менделеева?
Таблица Менделеева содержит все известные химические элементы, начиная с водорода (H) и заканчивая оганессоном (Og).
Как элементы расположены в таблице Менделеева?
Элементы в таблице Менделеева расположены в порядке возрастания атомного номера от верхнего левого угла до нижнего правого. Они группируются по периодам и группам в соответствии с их химическими свойствами и электронной структурой.
Что означают периоды и группы в таблице Менделеева?
Периоды в таблице Менделеева - это горизонтальные строки, обозначающие количество электронных оболочек у элементов. Группы - это вертикальные столбцы, где элементы имеют схожую химическую активность и одинаковое количество электронов на внешней энергетической уровне.
Какие свойства элементов можно определить по таблице Менделеева?
По таблице Менделеева можно определить такие свойства элементов, как атомный номер, атомную массу, химический символ, расположение в периодах и группах, внешнюю электронную конфигурацию, химическую активность, физические свойства, такие как плотность, точку плавления и кипения, а также представление исходной составляющей вещества.
Какие элементы являются самыми реактивными в таблице Менделеева?
Самыми реактивными элементами в таблице Менделеева являются элементы из первой группы (щелочные металлы) и элементы из седьмой группы (галогены). Например, натрий (Na) и хлор (Cl) являются высокореактивными элементами.