Сегодняшние научные открытия в области физики атома позволяют нам взглянуть на его внутреннюю структуру и понять важную роль, которую выполняют протоны и нейтроны в процессах, происходящих в нем. Распределение этих элементарных частиц, самых фундаментальных строительных блоков мира, является одной из ключевых характеристик, определяющих свойства атома и его взаимодействия с окружающей средой.
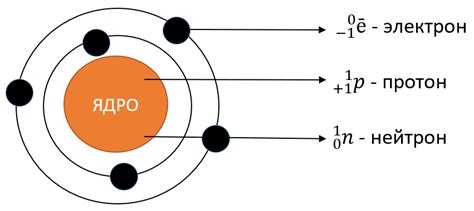
Протоны и нейтроны, главные герои нашей истории, находятся в атоме в особых областях, называемых ядрами. Они существуют в узком пространстве, которое можно представить себе как центральное ядро атома, а остальные компоненты, включая электроны, вращаются вокруг него.
Важно отметить, что протоны и нейтроны имеют разные свойства и выполняют разные функции в атоме. Протоны обладают положительным зарядом и, как это ни странно, даже среди них найдется некое разнообразие – эти частицы имеют различные массы, хоть и отличающиеся незначительно. Нейтроны же являются своего рода непроизводными "нейтралами" и не имеют заряда. Они играют важную роль в поддержании стабильности атома и определяют его изотопический состав.
Структура атома: основные характеристики
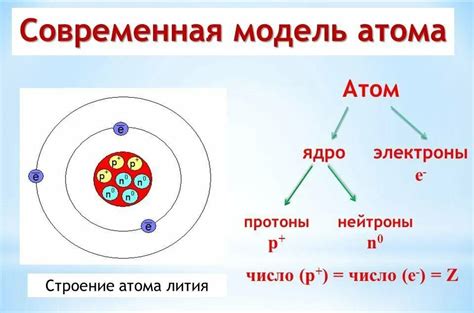
Атом -- основная строительная единица материи, обладающая внутренней структурой, которая играет ключевую роль во всех химических и физических процессах. Ядро, являющееся непосредственным центром атома, содержит протоны и нейтроны, которые обладают определенными свойствами, такими как масса и электрический заряд. Уникальные сочетания этих элементарных частиц в ядре определяют химические свойства элемента и его массовое число. Следует отметить, что оболочки, располагающиеся вокруг ядра, содержат электроны, которые занимают определенные энергетические уровни и участвуют в химических реакциях и связях между атомами.
Исходя из сказанного, строение атома является сложной и важной системой, которая определяет его физические и химические свойства. Комбинированное взаимодействие протонов, нейтронов и электронов обеспечивает стабильность атома и его устойчивость. Наличие разных элементов в природе и их различные химические свойства объясняются различными конфигурациями ядра и оболочек, что делает строение атома одной из ключевых основ понимания многообразия веществ и их поведения в химических реакциях.
Протоны и нейтроны: существенные различия и роли
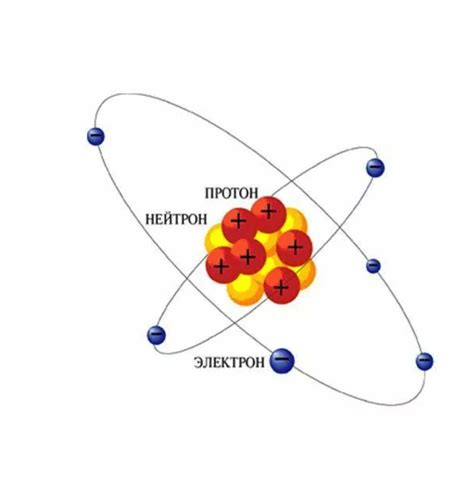
Протоны и нейтроны являются частицами, составляющими ядро атома. Они отличаются не только в их электрическом заряде, но и в их функциональных ролях.
Протоны - это положительно заряженные частицы, каждая из которых имеет элементарный заряд. Они играют важнейшую роль в структуре атома, так как определяют его идентификацию - количество протонов определяет химический элемент. Сумма протонов и нейтронов в ядре определяет ядерную массу.
Нейтроны, как следует из их названия, не имеют никакого электрического заряда и являются нейтральными. Они служат для увеличения ядерной массы. Количество нейтронов может варьироваться в ядрах атомов одного и того же элемента, что называется изотопами.
Сочетание протонов и нейтронов в ядре определяет стабильность атома. Количество протонов и нейтронов должно быть в балансе друг с другом, чтобы обеспечить ядру необходимую устойчивость.
Таким образом, протоны и нейтроны играют важную роль в структуре атома, определяя его основные свойства и химическую природу. Понимание их основных отличий и функций позволяет глубже погрузиться в физику атомных ядер и химических процессов.
Электроны: важнейшая роль в формировании электростатического баланса атома

В атоме наличие электронов играет существенную роль при формировании его электростатического баланса. Они обладают отрицательным зарядом и находятся в постоянном движении вокруг ядра, создавая необыкновенно сложную систему электроны. Благодаря взаимному притяжению с положительно заряженными протонами в ядре, электроны распределяются вокруг ядра таким образом, чтобы максимально устранить электростатическое отталкивание между ними.
Количество электронов и их энергетические уровни определяют основные свойства атома. Каждый электрон обладает некоторым определенным количеством энергии и может занимать различные орбитали вокруг ядра. Энергетические уровни электронов могут быть представлены в виде как набора «слоев», где каждый слой содержит фиксированное количество подуровней, доступных для заполнения электронами. Заполнение электронами этих возможных подуровней приводит к образованию электронных оболочек с разной степенью заполнения.
Важно отметить, что свойства электронов, такие как масса, заряд и спин, также влияют на распределение зарядов в атоме. Именно за счет электронов атом приобретает электрическую нейтральность, так как их отрицательный заряд полностью компенсирует положительный заряд ядра. Также, взаимодействие электронов с внешней средой определяет реакционную способность атома и его склонность образовывать химические связи.
Следовательно, электроны играют важную роль в распределении зарядов в атоме, обеспечивая его стабильность и возможность взаимодействия с другими атомами. Понимание и изучение их поведения и свойств является фундаментальным для полного понимания структуры и характеристик атомов и молекул.
Связь периодической системы элементов с атомным строением: история и тенденции
В периодической системе элементов принят принцип атомного строения, согласно которому каждый элемент характеризуется такими параметрами, как атомный номер, массовое число и массовая доля. Атомный номер равен числу протонов в атоме элемента, а массовое число представляет собой сумму протонов и нейтронов в ядре. Различные элементы обладают разным числом нейтронов, что влияет на их ядерные и химические свойства.
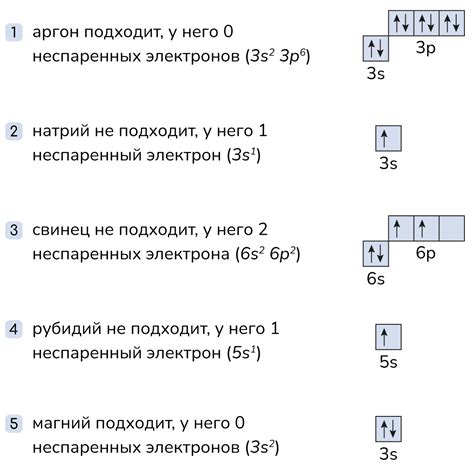
Анализ периодической системы элементов позволяет установить закономерности в распределении протонов и нейтронов в атомах. Так, в первом периоде элементов, состоящем только из водорода и гелия, нейтронов практически нет. В более тяжелых элементах, таких как углерод, кислород и железо, число нейтронов увеличивается по сравнению с числом протонов. При достижении более тяжелых элементов, таких как уран или плутоний, нейтронов становится значительно больше, что вносит существенные изменения в их физические и химические свойства.
Таким образом, распределение протонов и нейтронов в атоме является фундаментальным свойством элементов, определяющим их положение в периодической системе. Эта связь позволяет установить закономерности в строении и свойствах элементов и служит основой для дальнейших исследований и прогнозирования новых веществ и соединений.
Атомы в состоянии ионизации: влияние на протонно-нейтронную структуру
При образовании положительно заряженных ионов, атом теряет один или несколько электронов, что приводит к увеличению количества протонов по сравнению с нейтронами. Такое изменение баланса приводит к возникновению положительного заряда иона и влияет на его химические и физические свойства.
Следует отметить, что процесс образования отрицательно заряженных ионов включает в себя приобретение атомом одного или нескольких электронов. В этом случае, атом приобретает дополнительные электроны, что приводит к возникновению отрицательного заряда. В балансе протонов и нейтронов атома наблюдается преимущество нейтронов над протонами.
| Тип иона | Протоны | Нейтроны |
|---|---|---|
| Положительно заряженный ион | Увеличено | Уменьшено |
| Отрицательно заряженный ион | Уменьшено | Увеличено |
Однако стоит отметить, что изменение баланса протонов и нейтронов в ионе не влияет на общее количество ядерных частиц. Таким образом, ионизация атомов приводит к изменению заряда атомов и их свойств, но не влияет на общую массу ядра.
Понятие изотопа и его влияние на состав ядра
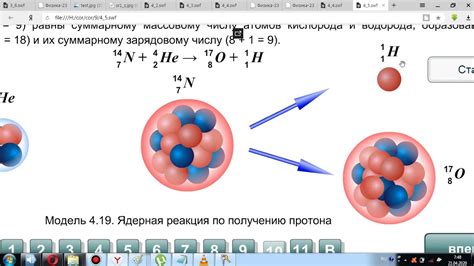
Существует несколько основных способов обозначения изотопов. Один из них - указание общего числа нуклонов в ядре, которое представляется суммой протонов и нейтронов. Другой способ - указание атомного числа и массового числа элемента, где атомное число обозначает количество протонов в ядре, а массовое число - сумму протонов и нейтронов.
Изотопы могут иметь различное количество нейтронов, что влияет на их стабильность и радиоактивность. Некоторые изотопы являются стабильными и не подвержены распаду, в то время как другие, с большим количеством нейтронов, могут быть радиоактивными и претерпевать различные типы распада. Эти различные свойства изотопов имеют важное значение для медицины, науки и промышленности.
- Изотопы используются в медицинской диагностике и терапии, например, при проведении радиотерапии рака.
- Изотопы рассматриваются при анализе археологических находок и определении возраста различных материалов.
- Изотопы играют важную роль в изучении химических реакций и физических процессов.
- Изотопы используются в различных отраслях промышленности, например, в ядерной энергетике и производстве изотопных источников энергии.
Массовое число и атомное число: взаимосвязь с распределением зарядов в атоме

Массовое число обозначает суммарное количество протонов и нейтронов в атомном ядре. Это число определяет массу атома и является основой для классификации элементов в таблице Менделеева. Оно тесно связано с распределением зарядов в атоме, так как протоны обладают положительным зарядом, а нейтроны - не имеют заряда.
Атомное число, в свою очередь, указывает на количество протонов в ядре атома, определяя его химические свойства и положение в периодической системе элементов. Именно заряд ядра протонами обуславливает электронное облако атома и его распределение.
Распределение зарядов в атоме отражает его структуру и способность взаимодействовать с другими атомами, образуя химические соединения. Благодаря взаимосвязи массового числа и атомного числа с распределением зарядов в атоме, мы можем лучше понять основные свойства и характеристики элементов, а также их роль в химических реакциях и физических процессах.
Влияние квантовой механики и электронных оболочек на организацию ядерных частиц
В атоме не только протоны и нейтроны играют важную роль, но и электроны, организованные в электронные оболочки. Квантовая механика определяет особенности распределения этих частиц и их взаимодействие, воздействуя на общую структуру атома.
Организация протонов и нейтронов в атоме сильно зависит от электронных оболочек, которые представляют собой энергетические уровни, на которых находятся электроны. Каждая оболочка может содержать определенное количество электронов, а их распределение в этих оболочках подчиняется определенным правилам.
| Оболочка | Максимальное количество электронов |
|---|---|
| K | 2 |
| L | 8 |
| M | 18 |
Электроны в атоме занимают конкретные энергетические уровни, обозначаемые квантовыми числами. Каждый уровень может содержать несколько подуровней, а электроны могут занимать свободные или заполненные подуровни. Это определяет структуру и электронную конфигурацию атома, что в свою очередь влияет на распределение и организацию протонов и нейтронов в атомном ядре.
В то же время, квантовая механика устанавливает определенные ограничения на взаимодействие частиц в атоме. Например, принцип запрета Паули запрещает двум электронам в одной оболочке иметь одинаковые квантовые числа. Это приводит к отталкиванию электронов и обеспечивает более равномерное распределение электронов по оболочкам и, следовательно, протонов и нейтронов в ядре.
Изменение распределения частиц: радиоактивный распад
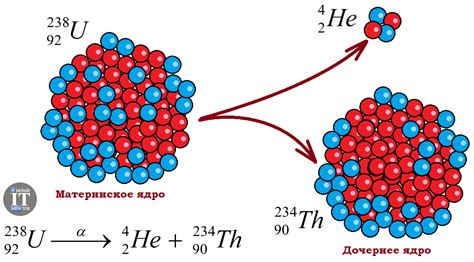
Радиоактивный распад может происходить по разным механизмам, в зависимости от характеристик атомного ядра. Одним из таких механизмов является альфа-распад, при котором ядро испытывает потерю альфа-частицы (которая состоит из двух протонов и двух нейтронов) и превращается в ядро другого элемента. Другим распространенным механизмом является бета-распад, когда протон в ядре превращается в нейтрон или наоборот.
Важным параметром радиоактивного распада является период полураспада - время, за которое половина ядер данного вида претерпит радиоактивный распад. Этот параметр может существенно отличаться для различных атомных ядер и может быть от нескольких миллисекунд до миллиардов лет.
| Механизм радиоактивного распада | Пример распада |
|---|---|
| Альфа-распад | 238U → 234Th + α |
| Бета-распад | 14C → 14N + β- |
Радиоактивный распад имеет широкий спектр применений, от использования его в медицине для диагностики и лечения рака до используется в археологии для определения возраста древних артефактов. Также радиоактивные элементы используются в современных ядерных реакторах для производства энергии.
Закон сохранения заряда: взаимосвязь с распределением электрического заряда в атоме

В физике существует основополагающий закон, который гласит о том, что электрический заряд в системе изолирована от внешнего мира сохраняется. Это означает, что сумма зарядов системы не изменяется со временем. Закон сохранения заряда имеет прямое отношение к распределению электрического заряда в атоме, который обусловлен наличием протонов и нейтронов.
Протоны являются элементарными частицами, обладающими положительным электрическим зарядом, а нейтроны не имеют заряда. В атоме протоны и нейтроны находятся внутри ядра, в то время как электроны располагаются в орбиталях вокруг ядра. Распределение протонов и нейтронов в атоме влияет на электрический заряд атома в целом и таким образом связано с законом сохранения заряда.
- Протоны, обладающие положительным зарядом, определяют общий положительный заряд атома. Количество протонов в атоме равно атомному номеру и определяет его химические свойства.
- Нейтроны, не имеющие заряда, не влияют на электрический заряд атома, но оказывают важное влияние на его стабильность и ядерные свойства.
Важно отметить, что распределение протонов и нейтронов в атоме может меняться в зависимости от изотопа элемента. Изотопы отличаются друг от друга количеством нейтронов в ядре, что влияет на их ядерные свойства и стабильность.
Таким образом, закон сохранения заряда играет важную роль в понимании распределения электрического заряда в атоме и его связи с протонами и нейтронами. Понимание основных принципов и свойств атома позволяет более глубоко изучать множество физических явлений и является фундаментом для многих областей науки.
Вопрос-ответ

Зачем протоны и нейтроны распределены в атоме?
Протоны и нейтроны распределены в атоме для обеспечения его стабильности и сохранения электрического равновесия. Протоны, заряженные частицы, находятся в ядре атома и создают положительный заряд, в то время как нейтроны, нейтральные частицы, также находятся в ядре и не имеют заряда. Распределение протонов и нейтронов позволяет удерживать электроны в области вокруг ядра, образуя структуру атома.
Какие основные принципы лежат в основе распределения протонов и нейтронов в атоме?
Основными принципами распределения протонов и нейтронов в атоме являются законы электростатики и ядерные силы. Законы электростатики определяют взаимодействие заряженных частиц и обеспечивают сбалансированное распределение протонов и электронов. Ядерные силы обеспечивают сцепление протонов и нейтронов в ядре атома и поддерживают его структуру и стабильность.
Каковы свойства протонов и нейтронов и как они влияют на распределение в атоме?
Протоны и нейтроны имеют различные свойства, влияющие на их распределение в атоме. Протоны обладают положительным электрическим зарядом и определяют химические свойства атома, такие как его валентность и реактивность. Нейтроны не имеют заряда, но влияют на стабильность ядра атома и его массу. Распределение протонов и нейтронов в атоме зависит от их взаимодействия с другими частицами и является основой для формирования разных изотопов и элементов.
Какие процессы могут изменить распределение протонов и нейтронов в атоме?
Распределение протонов и нейтронов в атоме может быть изменено различными процессами, такими как ядерные реакции, радиоактивный распад и ядерные цепные реакции. В результате этих процессов могут образовываться новые изотопы с измененным числом протонов и нейтронов, что может привести к изменению свойств атома. Например, радиоактивный распад приводит к убыванию числа протонов и нейтронов в ядре атома со временем.