В химии существует важное понятие окислительно-восстановительных реакций, которые играют важную роль не только в лабораторных условиях, но и в повседневной жизни. Однако, чтобы понять, где находится вещество, являющееся восстановителем, и где окислителем, необходимо знать некоторые ключевые принципы и химические свойства.
Окислительно-восстановительные реакции являются процессом передачи электронов между различными веществами. Окислитель – это вещество, которое способно принять электроны, тем самым окисляя другое вещество. Восстановитель – это вещество, которое отдает электроны и тем самым восстанавливает другое вещество.
Как же определить, где находится окислитель, а где – восстановитель? Один из подходов – взглянуть на электронную конфигурацию вещества и его окислительное состояние. Обычно, химические элементы имеют определенное окислительное состояние, которое указывает на их склонность либо к окислению, либо к восстановлению.
Понятия восстановителя и окислителя в химических реакциях

В процессе многих химических реакций элементы могут выполнять разные роли: то они могут принимать электроны и уменьшаться в своей степени окисления, то наоборот, отдавать электроны и увеличивать свою степень окисления. В химии для обозначения этих ролей используются понятия восстановителя и окислителя. Определить, какой элемент в данной реакции выполняет роль восстановителя, а какой окислителя, можно с помощью анализа изменений в степенях окисления элементов.
Восстановитель – это вещество или элемент, способное отдавать электроны и увеличиваться в своей степени окисления. Окислитель же наоборот, способен принимать электроны и уменьшаться в своей степени окисления. Ключевым моментом в определении этих понятий является изменение степени окисления элементов во время реакции. Обычно восстановителю соответствует элемент, у которого степень окисления уменьшилась, а окислителю – элемент с увеличенной степенью окисления.
Определение восстановителя и окислителя в химической реакции очень важно для понимания ее характера и механизма. Эти роли веществ могут быть определены на основе знаний о тенденциях изменения степеней окисления элементов в периодической системе, а также на основе знаний о сильных окислителях и восстановителях. Правильное определение этих понятий позволяет проводить более точные оценки степени окисления и реакционной активности веществ, а также понимать, как изменяется электронный баланс в процессе химической реакции.
Понятие восстановления и окисления

| Понятие | Восстановление | Окисление |
|---|---|---|
| Описание | Процесс, в ходе которого вещество приобретает электроны и понижает свою степень окисления | Процесс, в ходе которого вещество теряет электроны и повышает свою степень окисления |
| Примеры | Восстановительные реакции включают процессы, где вещества с высокой электроотрицательностью передают электроны веществам с низкой электроотрицательностью | Окислительные реакции, наоборот, приводят к потере электронов в результате взаимодействия веществ |
| Электроны | Восстановитель получает электроны, становится восстановленным | Электроны переходят с окисляемого вещества на окислитель, что приводит к его окислению |
Восстановитель и окислитель являются ключевыми понятиями в химических реакциях, так как позволяют определить поток электронов и дать количественную оценку процессов окисления и восстановления веществ. Понимание этих процессов помогает в выявлении веществ, способных передвигать электроны, и создает базу для различных химических реакций и применений.
Основные принципы выявления веществ, способных к окислению и восстановлению

В химии, окислители и восстановители являются ключевыми понятиями, которые описывают способность соединений переносить электроны в реакциях окисления-восстановления. Окислители обладают способностью получать электроны, тогда как восстановители, наоборот, передают электроны другим веществам.
Окислители и восстановители обычно реагируют с другими веществами, проявляя активность восстановления и окисления. Изучение химических реакций позволяет нам определить, какое вещество претерпевает окисление, а какое – восстановление. Важно заметить, что роль окислителя или восстановителя может варьироваться в зависимости от условий реакции.
Для определения роли веществ в окислительно-восстановительных реакциях используются различные методы и анализы. Один из них основан на изменении степеней окисления атомов элементов в соответствующих соединениях. Вещества, которые проявляют тенденцию к увеличению степени окисления, считаются окислителями, а те, которые наоборот – восстановителями.
Другим методом является определение переносимого электрона с помощью электрохимических методик. Исследование потенциала электродов в реакции помогает выявить, какое вещество переносит электрон и, следовательно, является окислителем или восстановителем.
Основные принципы определения восстановителей и окислителей позволяют нам лучше понять процессы окисления и восстановления в химических реакциях. Изучение роли веществ в этих процессах является необходимым шагом для понимания множества физических и химических явлений, а также для развития новых материалов и технологий.
Методика расчета электрохимического потенциала

Мы уже разобрались с понятиями "восстановитель" и "окислитель", и теперь настало время погрузиться в математические аспекты электрохимии и узнать, как можно определить электрохимический потенциал.
Для начала, давайте вспомним о понятии "потенциал". В общем смысле, это мера силы, способной совершить работу. В электрохимии, это отношение электрической энергии к заряду. Поэтому, электрохимический потенциал можно рассматривать как силу, с которой происходит окислительно-восстановительная реакция.
Для определения электрохимического потенциала, используется формула, которая связывает его с концентрацией реагентов и продуктов реакции. Эта формула называется уравнением Нернста, и она позволяет нам вычислить потенциал в зависимости от факторов, влияющих на реакцию.
Уравнение Нернста имеет вид: E = E° - (RT/nF)lnQ, где E - электрохимический потенциал, E° - стандартный электродный потенциал, R - газовая постоянная, T - температура в кельвинах, n - количество электронов, участвующих в реакции, F - постоянная Фарадея, Q - константа равновесия.
Используя уравнение Нернста, мы можем рассчитать электрохимический потенциал реакции, зная значения стандартного электродного потенциала и другие параметры системы. Такой подход к расчету дает нам возможность визуализировать и предсказывать итоговый результат исследуемой реакции.
- Понятие электрохимического потенциала
- Уравнение Нернста для расчета потенциала
- Значимость расчета электрохимического потенциала
Способы определения веществ, проявляющих свойства окислителей

В химии существует ряд способов определения веществ, которые обладают свойствами окислителей. При использовании этих методов можно выявить их способность получать электроны, приводя их окружающие соединения в окисленное состояние.
Один из таких способов - использование вещества, которое известно своими сильными восстановительными свойствами. Понимание, что вещество является окислителем, может быть получено путем наблюдения за его взаимодействием с другими веществами. Если данное вещество способно окислять другое, то оно может считаться окислителем. Кроме того, окислитель может вызывать изменение цвета или образование газов на протяжении реакции.
Дополнительно, можно использовать специальные индикаторы, которые меняют цвет в зависимости от окислительного или восстановительного действия вещества. Такие индикаторы представляют собой обычно органические соединения, которые обладают различными окрасками в зависимости от своего окислительного или восстановительного состояния.
Таким образом, определение окислителей можно осуществить с помощью наблюдений за их реакционной активностью, использования электрореактивных методов и специальных индикаторов. Знание о свойствах окислителей позволяет более глубоко понять процессы окисления и восстановления в химических реакциях.
Методы выявления веществ, проявляющих свойства восстановителей

В химии существует множество различных методов, позволяющих определить наличие и свойства восстановителей. Эти методы основаны на изучении химических реакций и взаимодействий веществ с окислителями или другими реагентами.
Одним из таких методов является метод электрохимического определения, суть которого заключается в использовании электрического тока для определения свойств вещества. При проведении электрохимического анализа восстановителей, изучаются их способность принимать электроны и возвращаться в свою исходную окисленную форму. Используя специальные электроды, аналитик может определить восстановительные свойства вещества, основываясь на измерении электрического сигнала, возникающего в результате реакции.
Другим методом, широко применяемым в определении восстановления веществ, является метод окислительно-восстановительного титрования. Этот метод основан на химической реакции между исследуемым веществом и окислителем, где окислитель принимает электроны от восстановителя. Путем добавления известного объема окислителя и мониторинга изменения окраски раствора или изменения pH можно определить свойства вещества в качестве восстановителя.
Также существуют методы спектрального анализа, использующие электромагнитное излучение для определения восстановительных свойств веществ. Некоторые вещества имеют способность поглощать свет или излучать его при прохождении через раствор или образец. Путем измерения поглощения или испускания определенных длин волн можно получить информацию о восстановительности вещества.
Применение химических реактивов и специальных индикаторов в процессе выявления окислителей

В химической аналитике для определения окислителей широко применяется использование специальных реактивов и индикаторов, которые позволяют провести точное определение их присутствия и реакционной активности. Эти вещества обладают свойством изменять свою окраску или форму при вступлении в реакцию с окислителем, что позволяет визуально определить его присутствие.
Для выявления окислителей могут быть использованы разнообразные вещества, например, пероксиды, хлориды и бромиды, а также органические соединения, такие как марганцовые и хромовые соединения. Индикаторы, в свою очередь, являются специально подобранными веществами, которые при добавлении к анализируемой смеси меняют свой цвет или форму в зависимости от происходящей реакции.
Процесс определения окислителей с использованием реактивов и индикаторов может быть достаточно простым и надежным способом. Например, для определения присутствия пероксидов можно использовать перманганат калия (KMnO₄) или дихромат калия (K₂Cr₂O₇) в качестве окислителей. При добавлении этих реактивов к анализируемому образцу и последующем встряхивании смеси можно наблюдать изменение их окраски, что указывает на присутствие окислителя. Другие реактивы и индикаторы обладают свойством образовывать осадок, менять показы фенольной и азо-формы и прочие изменения, которые также позволяют определить окислитель.
Роль электролитов в определении редукционных и окислительных веществ

Различение между редукционными и окислительными веществами в химических реакциях играет важную роль в определении ионов, способных восстанавливаться или окисляться. Один из методов, используемых для определения этих веществ, связан с ролью электролитов.
Электролиты - это вещества, способные в растворе или плавленом состоянии разлагаться на положительно и отрицательно заряженные ионы. В процессе окисления или восстановления реакционная среда может содержать различные электролиты, которые могут взаимодействовать с веществами, проходящими окислительно-восстановительные реакции.
Важным аспектом определения редукционных и окислительных веществ является их способность к реакции соответственно с восстановителями и окислителями. В качестве восстановителей выступают те вещества, которые способны восстановить другое вещество путем передачи электронов. Окислителями являются вещества, способные принять электроны от другого вещества и самостоятельно окислиться.
Взаимодействие электролитов с редукционными и окислительными веществами позволяет определить, какие ионы в реакции имеют способность окисляться или восстанавливаться. Для этого проводятся химические эксперименты, в которых в присутствии электролитов реагенты проявляют свои окислительные или восстановительные свойства. Это помогает установить их роли в конкретной реакции и определить, какие вещества являются редукционными, а какие – окислительными.
Таким образом, электролиты играют важную роль в определении редукционных и окислительных веществ в химических реакциях. Их взаимодействие и реакция с восстановителями и окислителями позволяют установить, какие ионы обладают способностью восстанавливаться или окисляться в процессе окислительно-восстановительных реакций.
Определение окислителей и восстановителей с помощью потенциометрии

Для определения окислителей и восстановителей с помощью потенциометрии применяются специальные электроды - основная часть потенциометра. В зависимости от цели исследования, может быть использован один или несколько электродов.
- Окислитель - вещество, способное отдавать электроны. При контакте с реагентами наблюдается повышение потенциала, что свидетельствует о его окислительных свойствах.
- Восстановитель - вещество, способное принимать электроны. При контакте с реагентами наблюдается понижение потенциала, что говорит о его восстановительных свойствах.
Процесс определения окислителей и восстановителей с помощью потенциометрии может быть представлен в виде визуального графика, на котором отображаются изменения потенциала в зависимости от времени и концентрации вещества. Анализ такого графика позволяет точно определить, какое из реагентов является окислителем, а какое - восстановителем.
Использование потенциометрии в определении окислителей и восстановителей позволяет более точно и надежно проводить анализ химических систем. Этот метод широко применяется в различных областях, таких как анализ питательных растворов в сельском хозяйстве, определение концентрации веществ в фармацевтической промышленности, а также исследования в области экологии и биологии.
Специфика определения восстановителей в органических реакциях

Окислитель – вещество, способное принимать электроны от другого вещества, тем самым окисляя его. Восстановитель – вещество, способное отдавать электроны другим веществам, тем самым восстанавливая их. Восстановитель всегда будет окисляться сам, а окислитель будет восстанавливаться.
- Изменение окислительного числа атома вещества;
- Изменение окислительно-восстановительного потенциала соединений;
- Изменение электрохимического потенциала реакции;
- Наличие функциональных групп в молекуле, способных принимать или отдавать электроны.
Определение восстановителей и окислителей в органических реакциях требует точного анализа всех указанных выше факторов. Наблюдение за изменениями в окислительно-восстановительном потенциале и окислительных числах позволяет определить, какие атомы и группы в молекуле участвуют в передаче электронов. Это является неотъемлемой частью изучения органической химии и помогает понять основные принципы реакций и взаимодействий соединений.
Практические примеры определения восстановителей и окислителей
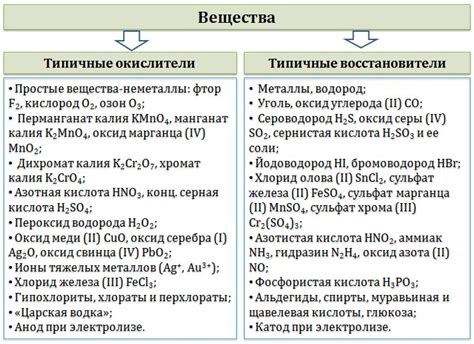
Практическими примерами могут быть множество реакций, в которых обнаруживается окислитель и восстановитель. Например, в реакции горения металла в кислороде, металл выступает восстановителем, так как отдает электроны, а кислород – окислителем, так как принимает электроны. Аналогично, в реакции, где хлор выступает в качестве окислителя и водород – восстановителя, хлор окисляет водород, принимая его электроны.
Определение окислителя и восстановителя в реакциях может быть неочевидным, поэтому важно уметь анализировать процессы и идентифицировать роли веществ. Здесь помогает знание электрохимии и способности вещества принимать или отдавать электроны. Часто окислитель и восстановитель можно определить по изменению окислительного числа атомов веществ, а также по изменению цвета или состояния веществ после реакции.
Понимание ролей веществ в реакциях окисления и восстановления позволяет предсказывать химические процессы, а также применять их в различных областях, например, в анализе веществ и создании новых соединений.
Вопрос-ответ

Что такое восстановитель и окислитель?
Восстановитель и окислитель - это химические вещества, участвующие в реакциях окисления-восстановления. Восстановитель - это вещество, способное отдать электроны другому веществу, при этом само становится окисленным. Окислитель - это вещество, способное принять электроны от другого вещества, при этом само становится восстановленным.
Как можно определить, что вещество является восстановителем?
Если вещество способно связывать электроны с другим веществом и при этом само окисляется, то это можно считать восстановителем. Восстановитель может быть определен по его способности принимать электроны и изменять свою степень окисления.
Чем определяется окислитель?
Способностью отдавать электроны другим веществам и изменять свою степень восстановления. Если вещество способно принимать электроны и при этом само восстанавливается, то оно является окислителем.
Можете привести примеры восстановителей и окислителей?
Например, металлы, такие как железо, алюминий и цинк, являются хорошими восстановителями, так как они способны отдать свои электроны и окислиться. А вещества, содержащие кислород, хлор или водород, например кислородные газы и хлориды, могут быть хорошими окислителями, так как они способны принять электроны и восстановиться.
Какие методы можно использовать для определения восстановителей и окислителей?
Одним из методов является измерение изменения электрохимического потенциала в реакции. Также можно использовать методы спектроскопии и хроматографии для анализа химических свойств веществ и их способности принимать или отдавать электроны.