Периодическая система химических элементов является великим творением ума человека, в котором нашли свое отражение основные закономерности и связи между различными химическими элементами. Изучение расположения металлов в этой системе предоставляет нам уникальную возможность понять причины и последствия множества химических свойств и реакций.
Этот раздел посвящен анализу основных закономерностей, которые относятся к распределению металлов в периодической системе. Здесь мы рассмотрим группы элементов, являющихся металлами, и обсудим их сходства и различия, а также важность этих свойств в химических процессах.
Одно из наиболее заметных свойств металлов - их способность проводить электричество и тепло. Благодаря своей структуре и особенностям электронной оболочки, эти элементы обладают высокой подвижностью электронов, что позволяет им эффективно передавать энергию. Благодаря этому, металлы широко используются в различных областях - от электротехники до машиностроения и строительства.
Металлы и позиция в периодической таблице элементов
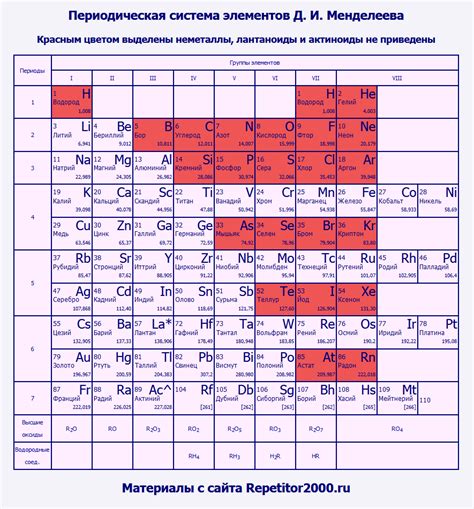
Раздел "Металлы и позиция в периодической таблице элементов" посвящен изучению разнообразных металлических элементов в контексте их распределения в периодической системе. Этот раздел представляет собой анализ взаимосвязей между различными свойствами металлов и их уникальными местами в периодической таблице.
Металлы - это важная группа элементов, обладающих широким спектром уникальных химических и физических свойств. Они характеризуются высокой электропроводностью, теплопроводностью и пластичностью. Важными атрибутами металлов являются блеск, металлический блеск, и их способность образовывать положительные ионы. Металлы представлены в различных группах и периодах периодической таблицы элементов.
Каждая группа металлов, расположенных в периодической системе, имеет свои особенности, связанные с электронной структурой и химическими свойствами. Данные особенности предопределяют способность металлов образовывать соединения, взаимодействовать с другими элементами и проявлять реактивность в различных химических реакциях.
Исследования позволяют выявить закономерности в свойствах металлов и их распределении в периодической таблице. Понимание этих закономерностей способствует лучшему изучению состава и структуры металлов, а также применению их в различных сферах деятельности человека, начиная от электроники и промышленности, заканчивая медициной и архитектурой.
Классификация металлов в периодической таблице
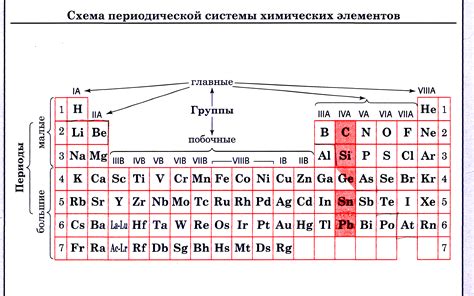
Когда рассматриваем расположение химических элементов в периодической системе, невозможно не обратить внимание на классификацию металлов. Эти вещества обладают определенными характеристиками и особенностями, которые делают их незаменимыми во многих отраслях науки и промышленности.
Одной из ключевых особенностей классификации металлов является их расположение в периодической таблице. За исключением небольшого количества элементов, большинство металлов находятся в левой части таблицы. Это связано с их общими химическими свойствами, такими как высокая теплопроводность и электропроводность, способность образовывать ионные соединения и т.д.
Металлы также могут быть классифицированы по своей реактивности и способности образовывать соединения с другими элементами. Некоторые металлы, называемые щелочными и щелочно-земельными металлами, очень реактивны и легко образуют ионные соединения с галогенами, например. Другие металлы, такие как переходные металлы, имеют более сложные структуры и образуют соединения с различными элементами в зависимости от условий реакции.
Кроме того, металлы также могут быть классифицированы по своей массе и плотности. Некоторые металлы, такие как легкий алюминий, имеют малую плотность и весьма прочны, что делает их идеальными для использования в авиационной промышленности. Другие металлы, такие как свинец или ртуть, имеют большую плотность и используются в различных приборах и системах из-за их характеристик.
- Расположение металлов в периодической таблице
- Реактивность и способность к образованию соединений
- Классификация по массе и плотности
Структура таблицы Менделеева и расположение элементов с металлическими свойствами

Взаимосвязь положения металлов в таблице Менделеева и их химических характеристик
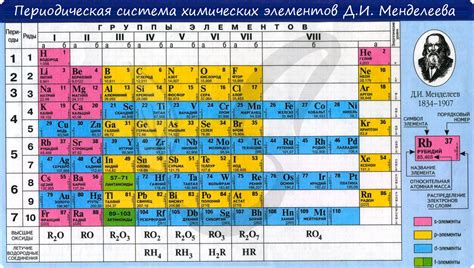
Каковы особенности и характеристики металлов? Как они зависят от их положения в таблице Менделеева? В данном разделе мы рассмотрим взаимосвязь между положением металлов и их химическими свойствами, исследовав общие закономерности и заключения, которые можно сделать о металлах в периодической системе.
Как известно, металлы обладают широким спектром химических свойств, таких как высокая электропроводность, теплопроводность, металлический блеск и способность образовывать положительные ионы. Однако, каждый металл имеет свои уникальные особенности и химические свойства, которые могут варьироваться в зависимости от его положения в периодической системе.
Положение металла в таблице Менделеева определяет его электронную конфигурацию, а следовательно, и его химическое поведение. Например, металлы в левой части периодической таблицы, такие как щелочные металлы и щелочноземельные металлы, обладают низкой ионизационной энергией и склонностью к образованию ионов положительного заряда, что проявляется в их активности и реакционной способности. С другой стороны, переходные металлы, расположенные в середине таблицы, обладают большей вариативностью своих окислительных состояний и способностью формировать разнообразные соединения.
Также важно отметить, что металлы в верхней части периодической таблицы, такие как благородные металлы (например, золото и платина), обладают устойчивой электронной конфигурацией и проявляют низкую химическую реакционность, что делает их ценными и редкими на практике.
Таким образом, положение металлов в периодической системе играет решающую роль в определении их химических свойств. Понимание этих закономерностей не только помогает в изучении и классификации металлов, но и имеет практическое значение для различных индустрий и областей, где металлы применяются в различных процессах и технологиях.
Сильные и слабые металлы: особенности и химические реакции
При изучении металлов мы можем выделить их на две основные категории - сильные и слабые. Сильные металлы отличаются особой степенью химической активности, проявляющейся в способности быстро реагировать с окружающими веществами. Они способны образовывать стойкие соединения, устойчивые к окислению и коррозии.
С другой стороны, слабые металлы обладают меньшей активностью и способностью к химическим реакциям. Они могут образовывать менее стойкие соединения, которые могут быть подвержены окислению и разложению под воздействием влаги или других веществ.
Однако, важно отметить, что разделение металлов на сильные и слабые не является абсолютным. Это скорее градиент, протягивающийся от одного экстремума к другому, так как существует целый спектр металлов с различной степенью химической активности и реакционной способностью.
Исследование особенностей и химических реакций сильных и слабых металлов позволяет нам лучше понять их роль в различных процессах, а также использовать их свойства в различных областях научных и технологических отраслей. Это открывает новые возможности для разработки более эффективных и устойчивых материалов, что имеет большое значение для нашей современной жизни и прогресса человечества.
Металлы и их способность к образованию ионов

Металлы отличаются от других химических элементов своей высокой электропроводностью и хорошей теплопроводностью. Они также обладают блеском и металлической структурой, которая обеспечивает им прочность и устойчивость. В периодической системе элементов металлы расположены в левой части таблицы и характеризуются различными физическими и химическими свойствами.
Одной из ключевых свойств металлов является их способность образовывать ионы. Ионы металлов образуются в процессе потери электронов из внешнего электронного слоя атома. Это связано с низкой энергией ионизации у металлов, что позволяет им легко отдавать электроны и образовывать положительно заряженные ионы, называемые катионами.
Образование ионов у металлов имеет важное значение в химических реакциях, так как именно ионы металлов обеспечивают проведение электрического тока в растворах и позволяют металлам растворяться в кислотах и образовывать соли. Ионы металлов также играют важную роль в множестве биологических процессов и являются неотъемлемой частью нашей повседневной жизни.
Взаимодействие металлических элементов с кислородом: создание соединений оксидов

Во время реакции с кислородным газом воздуха, металлы подвергаются окислению, что приводит к образованию оксидов. Соединения оксидов могут иметь различные химические и физические свойства. Некоторые оксиды обладают кислотными свойствами и способны реагировать с водой, образуя кислоты. В то время как другие оксиды могут быть щелочными или нейтральными, не образуя кислот.
Химические свойства, обусловленные образованием оксидов, зависят от того, какой элемент металла вступает в реакцию с кислородом. Это может изменять физические свойства оксидов, такие как цвет, растворимость в воде и температура плавления. Некоторые оксиды могут быть стабильными и не растворяющимися в воде, в то время как другие могут быть хорошо растворимыми.
Взаимодействие металлов с кислородом и образование оксидов имеют важные практические применения. Оксиды металлов используются в производстве стекла, керамики, красок и других материалов. Они также играют роль катализаторов в химических процессах и служат защитным покрытием для металлических поверхностей, предотвращая их коррозию.
Роль металлов в промышленности и технологиях

Они неизменно занимают важное место в самых разных отраслях промышленности и технологий. Металлы, с их уникальными физическими и химическими свойствами, находят применение в множестве областей, начиная от производства машиностроительных деталей и заканчивая созданием высокотехнологичных материалов и компонентов для электроники.
Одной из основных областей применения металлов в промышленности является машиностроение и автомобилестроение. Чугун, сталь, алюминий, медь и другие металлы используются для изготовления каркасов, деталей двигателей, подшипников, трубопроводов и многого другого. Благодаря прочности, устойчивости к воздействию окружающей среды и возможности легко подвергаться формообразованию, металлы обладают необходимыми свойствами для создания прочных и долговечных конструкций.
Электронная промышленность также не может обойтись без металлов. Алюминий, медь, золото и другие металлы находят широкое применение в создании электронных компонентов, проводников, контактных площадок и многого другого. Эти металлы обладают высокой электропроводностью, хорошей термической проводимостью и могут быть легко обработаны и спаяны, что делает их идеальными материалами для электронных устройств.
Технологии и процессы, связанные с производством и использованием энергии, также тесно связаны с металлами. Они используются в создании турбин, генераторов, солнечных батарей, электродов в аккумуляторах и многого другого. Благодаря своей прочности и хорошей термической и электрической проводимости, металлы способствуют эффективной генерации и передаче энергии.
Промышленность строительных материалов также полагается на металлы. Например, алюминий и сталь находят применение в создании каркасов и фасадов зданий, конструкций для мостов и других инфраструктурных объектов. Металлы обладают необходимой прочностью, устойчивостью к воздействию окружающей среды и долговечностью, что делает их идеальными материалами для строительства.
Роль металлов в технологиях и промышленности не может быть недооценена. Благодаря их уникальным свойствам, они широко применяются в различных отраслях, обеспечивая прочность, устойчивость и эффективность в процессах производства и использования разнообразных материалов и устройств.
Вопрос-ответ

Какие закономерности существуют в расположении металлов в периодической системе?
Расположение металлов в периодической системе имеет определенные закономерности. Одной из них является возрастание металлических свойств от правого края системы к левому. То есть, металлы справа в периодической системе обладают более выраженными металлическими свойствами, чем металлы слева. Кроме того, металлы снизу в периодической системе также обладают более высокой металличностью по сравнению с металлами сверху. Эти закономерности связаны с изменением электронной структуры и энергетическими уровнями атома металла в периодической системе.
Какие химические свойства характерны для металлов в периодической системе?
Металлы в периодической системе обладают несколькими характерными химическими свойствами. Они обычно обладают металлическим блеском, высокой теплопроводностью, электропроводностью и пластичностью. Также металлы имеют тенденцию образовывать положительные ионы, теряя свои валентные электроны. Большинство металлов также обладает способностью образовывать связи с неметаллами, образуя соли.
Почему металлы в периодической системе расположены именно так?
Расположение металлов в периодической системе определено их электронной структурой. Металлы имеют небольшое количество валентных электронов, которые легко переносятся с одной оболочки на другую. Наиболее металлическими свойствами обладают металлы с неполной оболочкой валентных электронов, которые могут легко стать положительно заряженными ионами. Поэтому металлы располагаются в верхней и средней части периодической системы, где они обладают максимальным числом валентных электронов.