Таинственное, словно закодированное послание. Именно так можно охарактеризовать периодическую систему химических элементов, в которой каждое ячейка несет в себе огромный поток информации о свойствах и характеристиках того или иного элемента. Биологические, физические, химические и многие другие закономерности могут быть обнаружены с помощью периодической системы, открывая перед нами бесконечный мир тайн и открытий.
Словно калейдоскоп, таблица элементов приглашает нас в путешествие по бесконечным просторам химии. В каждой строчке и столбце мы видим определенные закономерности, которые позволяют определить родственные элементы, предсказать химические свойства или прогнозировать поведение элементов при разных условиях.
Для того чтобы глубже понять законы природы и раскрыть тайны молекулярной структуры, необходимо разбираться в специфике строения периодической системы. Каждый элемент имеет свое собственное место в таблице, и каждое место несет в себе уникальную информацию о его химических свойствах. Физика, химия, биология - эти науки настолько тесно связаны между собой, что без понимания периодической системы далеко не уйдешь в их исследованиях.
Взаимное расположение химических элементов в платообразной схеме исторического периода
Химические элементы, обладающие различными свойствами и связанные между собой в естественных соединениях, расположены в историческом периоде в специфическом порядке их уровней. Этот порядок, в свою очередь, обусловлен закономерностями и законами, которые в основном связаны с физическими и химическими свойствами элементов.
- На первом уровне располагаются элементы, обладающие наименьшим атомным номером и наименьшей атомной массой. Они отличаются от остальных элементов наиболее высокими энергетическими характеристиками и самым низким энергетическим потенциалом.
- На втором уровне находятся элементы, обладающие слегка большими атомными номерами и атомными массами по сравнению с элементами на первом уровне. Свойства этих элементов частично повторяются, однако они также обладают новыми химическими свойствами, что делает их уникальными соединениями.
- Третий уровень представляет собой группу элементов, у которых атомные номера и атомные массы дальше превышают предыдущие уровни. Свойства их различаются от элементов на первых двух уровнях, однако существуют общие черты.
- Наконец, на самом верхнем четвертом уровне находятся элементы с самыми большими атомными номерами и атомными массами. Они обладают наиболее разнообразными и необычными свойствами, которые делают их особыми в сравнении с остальными элементами.
Перед организацией элементов на разные уровни исторического периода, ученые проводили исследования и эксперименты, чтобы определить закономерности и законы, которые управляют свойствами элементов. Их усилия помогли создать такую систему расположения, которая отражает основные свойства и характеристики элементов, делая их доступными для лучшего понимания и изучения.
Особенности структуры таблицы с элементами химического классификатора

Распределение элементов в таблице Менделеева представляет собой хорошо структурированную систему классификации, которая отражает свойства и особенности различных химических элементов. Каждый элемент расположен на определенном уровне, отражающем его энергетические уровни и электронную конфигурацию.
Классификация элементов основана на принципе упорядочения их по атомному номеру и химическим свойствам, что позволяет установить закономерности и законы, связанные с их распределением в периодической таблице.
Структура таблицы Менделеева включает в себя периоды и группы, где каждый период представляет собой горизонтальную строку, а каждая группа - вертикальный столбец элементов. Периоды отразят энергетические уровни электронов, а группы позволяют классифицировать элементы по своим химическим свойствам.
Особенности структуры таблицы Менделеева позволяют химикам и ученым легко определять и предсказывать свойства элементов, а также строить связи между ними. Систематическое расположение элементов в таблице облегчает поиск информации о химических свойствах конкретного элемента и понимание его места в химической классификации.
Значение горизонтальных строк в таблице элементов
Периоды играют ключевую роль в классификации элементов и помогают нам понять их химическое поведение и связи между ними. Каждая новая горизонтальная строка представляет следующее энергетическое уровней, включая атомы с большим числом электронов. Благодаря этому, таблица Менделеева обеспечивает удобную систему отображения изменений в активности элементов и изменения их свойств с ростом числа электронов.
На каждом последующем уровне, электроны располагаются на orbital, которые отличаются друг от друга по энергии и форме. Периодические закономерности и свойства элементов в большой степени определяются расположением этих orbital. Горизонтальные строки позволяют нам визуализировать изменение энергии, валентности и других физических и химических свойств, характерных для элементов, в пределах каждого периода.
Роль вертикальных столбцов в ПТ
Эти вертикальные столбцы, также известные как группы или семейства элементов, группируются в зависимости от сходства их химических свойств. Позиция элемента в столбце указывает на его общие химические свойства и связана с его электронной конфигурацией и положением в атоме. Таким образом, эти столбцы облегчают исследование определенных химических характеристик и предсказание свойств новых элементов.
Каждый вертикальный столбец представляет собой семейство элементов с аналогичной внешней электронной оболочкой и химическими свойствами. Например, элементы из одного столбца в основном имеют аналогичный способ вступления в химические реакции или образования соединений, что делает их группировку в столбцы особенно полезной при изучении и применении химии.
Периоды и группы в системе Менделеева: основные принципы
Периоды - это горизонтальные ряды элементов в таблице Менделеева. Каждый период представляет собой набор элементов, расположенных в одной энергетической оболочке. При переходе от одного периода к другому происходит изменение наибольшего квантового числа, отражающего уровень энергии электронов.
Группы - это вертикальные столбцы элементов в таблице Менделеева. Каждая группа содержит элементы с аналогичным количеством электронов во внешней оболочке. Группы также имеют общие химические свойства, что делает их основой для классификации элементов в периодической системе.
Понимание периодов и групп является ключевым для определения различных характеристик элементов, таких как их валентность, электроотрицательность и тенденции в химической активности. Эти принципы помогают нам систематизировать знания о химических элементах и предсказывать их свойства на основе их положения в таблице Менделеева.
В дальнейшем изучении периодов и групп мы углубимся в детали и связи между элементами, позволяющие нам лучше понять структуру и разнообразие химических элементов в периодической системе.
Правила организации кимических элементов в таблице Менделеева
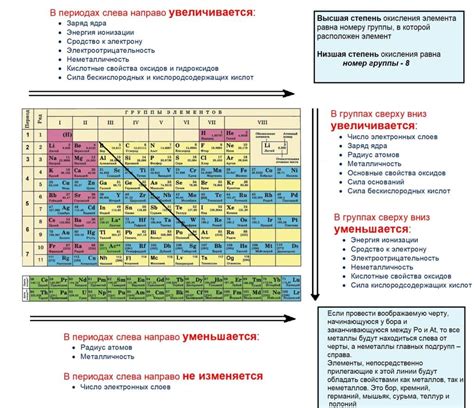
Одним из ключевых критериев при расположении элементов в таблице Менделеева является атомный номер, который отражает количество протонов в ядре атома. Благодаря этому свойству элементы располагаются в порядке возрастания атомного номера, что позволяет легко идентифицировать каждый элемент и определить его положение в таблице.
Еще одним важным фактором, влияющим на расположение элементов, является электронная конфигурация. Электронная конфигурация определяет распределение электронов по энергетическим уровням атома. С учетом этого свойства элементы группируются по блокам и периодам, отражая внутреннюю структуру атомов и их возможные химические связи.
Кроме атомного номера и электронной конфигурации, в расположении элементов учитываются и другие факторы, такие как атомный радиус, электроотрицательность и химическая активность. Все эти свойства определяют взаимодействие элементов и их способность образовывать различные соединения и реакции, что также отразено в таблице Менделеева.
| Периоды | Группы |
|---|---|
| 1 | 1 |
| 1 | 2 |
| 1 | 3 |
| 2 | 1 |
| 2 | 2 |
| 2 | 3 |
Свойства и характеристики химических элементов в организации периодической таблицы
В рамках изучения химических элементов воспользуемся определениями и параметрами, обеспечивающими полное представление о свойствах и характеристиках этих элементов в периодической системе. Основываясь на этой информации, мы сможем рассмотреть основные химические, физические и атомные свойства каждого элемента и понять их значение в химической науке и промышленности.
Определение расположения элементов в периодической системе через значимость электронной конфигурации

Концепция электронной конфигурации основана на распределении электронов в атоме по энергетическим уровням и подуровням. Это распределение происходит в соответствии с принципами заполнения, на которых основывается построение периодической системы. Зависимость между электронной конфигурацией и расположением элементов в периодической системе является неотъемлемой частью нашего понимания химии.
Каждый элемент имеет уникальную электронную конфигурацию, которая обуславливает его свойства и его место в периодической системе. Например, элементы одной группы имеют схожую электронную конфигурацию на внешнем энергетическом уровне, что делает их аналогичными по химическим свойствам.
Определение расположения элементов в периодической системе основывается на их электронной конфигурации и позволяет установить закономерности и тренды, которые влияют на химические свойства элементов. Изучение этой важной взаимосвязи является фундаментальным для понимания и объяснения реакционной способности и периодических закономерностей в химии.
Разделение на блоки: s, p, d, f

- Блок s:
- Блок p:
- Блок d:
- Блок f:
Первый блок, который находится внутри ядра атома, называется блоком s. Он включает в себя элементы, находящиеся в первых двух периодах периодической системы. Элементы этого блока обладают схожими свойствами и характеризуются полным заполнением электронной оболочки.
Блок p является вторым блоком в периодической системе и расположен после блока s. Он содержит элементы, находящиеся в третьем и более высоких периодах. Элементы блока p обладают свойством образования анионов с отрицательными зарядами и часто взаимодействуют с элементами других блоков.
Третий блок, называемый блоком d, находится между блоками s и p в периодической системе. Он содержит элементы, расположенные в середине таблицы Менделеева. Элементы блока d характеризуются наличием неполностью заполненной электронной оболочки и обладают множеством свойств, включая тяготение к образованию соединений с другими элементами периодической системы.
Оставшийся блок, блок f, находится в отдельной нижней части периодической системы. Он содержит ряды элементов, имеющих внешнюю оболочку, не полностью заполненную электронами. Элементы блока f обладают магнитными свойствами и часто используются в различных технологических процессах.
Переходные и благородные металлы в упорядоченной таблице элементов
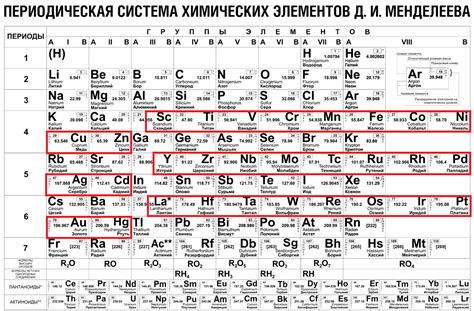
Переходные металлы являются элементами, имеющими свойства, промежуточные между алкалийными и благородными металлами. Они представлены во втором и третьем периоде таблицы элементов, находящихся между главной группой элементов и благородными металлами. Их внешний электронный уровень, в отличие от алкалийных металлов, заполняется не полностью, что обеспечивает более разнообразные химические свойства и возможность образования различных ионов с разной валентностью.
Благородные металлы, или металлы платиновой группы, являются наиболее устойчивыми и инертными элементами в периодической таблице. Они представлены в основной части таблицы Менделеева и встречаются в последнем периоде. Их внешний электронный уровень полностью заполнен, что обуславливает их стабильность и инертность в химических реакциях. Благородные металлы обладают высокими температурными и химическими устойчивостями, а также используются в различных промышленных и научных областях благодаря своим уникальным свойствам.
Таким образом, переходные и благородные металлы занимают определенные положения в упорядоченной таблице элементов, характеризуются различными электронными уровнями и обладают уникальными химическими свойствами. Понимание и изучение их местоположения и характеристик в таблице Менделеева позволяют лучше понять и объяснить особенности их взаимодействия и применение в различных областях науки и промышленности.
Значение взаимного расположения химических элементов в периодической системе для понимания связи и активности реакций

Периоды периодической системы отражают изменение энергии электронов в атомах. Чем ближе элемент к концу периода, тем выше энергия его внешних электронов. Это влияет на его склонность к взаимодействию с другими элементами и образованию химических связей.
Группы периодической системы отражают особенности расположения внешних электронов в атомах элементов. Так, элементы в одной группе имеют одинаковое число внешних электронов, что делает их химически похожими и определяет их реактивность и способность образовывать связи со сходными элементами.
Значение расположения элементов в периодической системе заключается в возможности анализировать эти связи и реакции на основе позиции в таблице. Взаимодействие элементов с разными свойствами зависит от их смежности в периодической системе, что обеспечивает понимание того, какие соединения они могут образовывать и какие свойства могут проявлять.
Вопрос-ответ

Какова структура таблицы Менделеева и каким образом в ней располагаются уровни?
Таблица Менделеева представляет собой организацию элементов химических элементов по возрастанию атомного номера и атомной массы. Уровни в таблице Менделеева обозначают периоды, которые горизонтально расположены от 1 до 7 и указывают на количество электронных оболочек в атомах элементов.
Какие свойства элементов изменяются с изменением уровня в таблице Менделеева и периодической системе?
С изменением уровня в таблице Менделеева и периодической системе меняются различные свойства элементов. Например, размер атомов обычно увеличивается с увеличением уровня, так как добавляются новые электронные оболочки. Кроме того, электроотрицательность и электроаффинность элементов также изменяются по закономерности в таблице Менделеева.
Какое значение имеет расположение уровней в таблице Менделеева и периодической системе для определения свойств элементов?
Расположение уровней в таблице Менделеева и периодической системе позволяет определить ряд свойств элементов. Например, количество электронных оболочек (уровней) говорит о размере атому и его электронной конфигурации. Это влияет на взаимодействие элементов при химических реакциях и их способность образовывать соединения.