В широком круге научных и инженерных дисциплин становящееся всё более актуальным понятие «уравнение Менделеева-Клапейрона» привлекает внимание ученых и специалистов. Оно отражает универсальную связь между физическими параметрами, позволяющую предсказывать и объяснять множество явлений и процессов в различных областях. Одной из фундаментальных констант в этом уравнении является R, который обладает важной ролью в выявлении взаимосвязей между различными переменными.
Применение уравнения Менделеева-Клапейрона в научном и техническом мировоззрении всегда вызывало интерес у специалистов. Оно позволяет предсказывать и объяснять поведение газов и идеальных газовых смесей, вещественных идеальных растворов, а также проводить анализ термодинамических процессов и реакций. Именно здесь и найдет свое место важная постоянная R, которая играет роль своеобразного ключа к пониманию различных физических и химических явлений.
Для построения уравнения Менделеева-Клапейрона и анализа различных систем необходимо правильное задание значений констант, среди которых ключевое место занимает R. Оно определяет пространственную и временную связь между различными параметрами, помогает выявить закономерности и законы, которые объясняют сложные физические и химические процессы. Благодаря своей единообразной природе, R позволяет установить общие зависимости не только в небольших системах, но и применять полученные знания к решению глобальных проблем и созданию новых технологий.
История открытия фундаментальной формулы: путь к пониманию уравнения Менделеева-Клапейрона
В этом разделе мы погрузимся в историю и изучим роль великих ученых, которые с помощью наблюдений, экспериментов и гениального мышления смогли сформулировать уравнение Менделеева-Клапейрона. Рассмотрим ключевые этапы открытия этой формулы и попытаемся понять, какие идеи и открытия легли в основу этого уравнения.
Поехали вглубь времени и вернемся в XVIII век, когда ученые начали проводить эксперименты с газами и обнаружили, что между объемом, давлением и температурой у газов существует некая связь. В отдельных случаях величины взаимосвязи проявлялись ярко, в других - не являлись столь очевидными. Однако, спустя время, ученые поняли, что существует всеобщее математическое выражение, которое объединяет все эти связи. В результате долгих исследований, работы и дедукций, основополагающее уравнение было сформулировано.
Перед вами предстоит погрузиться в мир открытий самых великих ученых, таких как Джозеф Луи Гай-Люссак, Андре Мари Ампер, Рудольф Клауссиус, Юган Джаккард, Джеймс Клерк Максвелл и других. Вы узнаете о их экспериментах, открытиях и вкладе в разработку уравнения Менделеева-Клапейрона. Также мы окунемся в напряженную жизнь Дмитрия Ивановича Менделеева и Жюли Клапейрона, которые сделали значительные открытия, создав основы для уравнения, которое получило их имена. Открытие уравнения Менделеева-Клапейрона стало важнейшим вехом в развитии химии и термодинамики, а его основные принципы и применение провели нас к новым горизонтам в науке и технологиях.
Основные составляющие формулы Менделеева-Клапейрона: строение и значения

В данном разделе мы рассмотрим основные компоненты уравнения Менделеева-Клапейрона и их важность в химических расчетах и физических исследованиях.
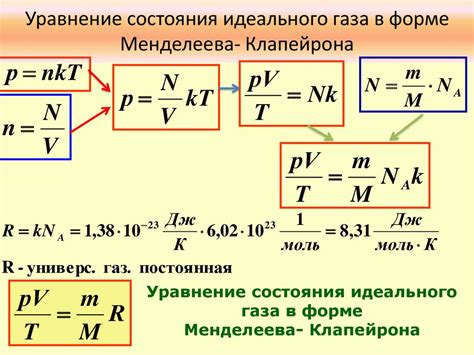
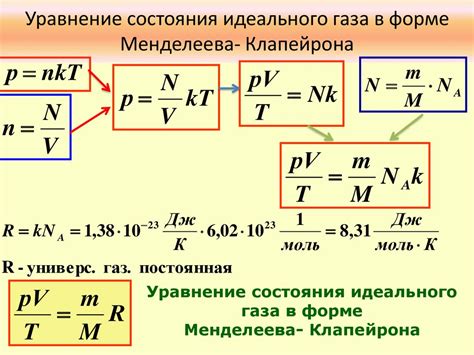
Одной из ключевых составляющих уравнения Менделеева-Клапейрона является газовая постоянная, обозначаемая символом R. Эта величина представляет собой константу, которая связывает между собой давление, объем, температуру и количество вещества газа. R является универсальной перемножающей постоянной, которая позволяет переходить от физических величин, измеряемых в разных единицах, к единой системе измерения.
Кроме того, в уравнении Менделеева-Клапейрона присутствует количество вещества газа, которое обычно обозначается буквой n. Оно измеряется в молях и является фундаментальной характеристикой вещества, позволяющей выразить количество атомов, ионов или молекул, содержащихся в данном объеме газа.
Давление газа, которое обозначается символом P, выражает силу, действующую на единицу площади поверхности. По уравнению Менделеева-Клапейрона, давление является пропорциональным наделенной энергией частиц и обратно пропорциональным объему газа и температуре.
Величина V обозначает объем газа и является мерой его пространственного расположения. Она измеряется в литрах, кубических метрах и других подобных единицах. По уравнению Менделеева-Клапейрона, объем газа прямо пропорционален количеству вещества и температуре, а обратно пропорционален давлению.
И наконец, температура газа, обозначаемая символом T, представляет собой меру средней кинетической энергии и движения частиц вещества. Она измеряется в градусах по шкале Цельсия, Кельвина или Фаренгейта. По уравнению Менделеева-Клапейрона, температура газа прямо пропорциональна энергии его частиц и объему, а обратно пропорциональна давлению и количеству вещества.
Таким образом, понимание и использование основных компонентов уравнения Менделеева-Клапейрона позволяет нам более глубоко изучить свойства газов и выполнить точные расчеты, имеющие практическое применение в различных областях науки и техники.
Универсальная газовая постоянная R: ее значимость и роль в физико-химических расчетах

R - это величина, характеризующая свойства газа и не зависящая от его состава и конкретных свойств вещества. Она обеспечивает связь между энергией молекул газа и его термодинамическими параметрами. Универсальная газовая постоянная R позволяет описывать поведение газов, а также выполнять пересчеты между разными единицами измерения и шкалами температуры.
Важно отметить, что значение R является константой в определенных условиях - при стандартных температуре и давлении. В различных масштабах исследований и в зависимости от условий эксперимента величина R может быть выражена в разных единицах измерения - от джоулей до калорий.
Универсальная газовая постоянная R имеет большое значение для практических расчетов в химической и физической науке. Ее использование позволяет описывать поведение и свойства газового состояния в различных условиях, что является необходимым для эффективного проектирования и оптимизации процессов в различных областях - от промышленности до научных исследований. Кроме того, универсальная газовая постоянная R является важным понятием для понимания законов и принципов термодинамики, которые лежат в основе физико-химических явлений и процессов.
Применение уравнения Менделеева-Клапейрона в химии и физике

Уравнение Менделеева-Клапейрона, также известное как уравнение состояния идеального газа, играет ключевую роль в области химии и физики. В своей сущности, оно представляет собой математическую модель, которая позволяет описывать взаимосвязь между давлением, объемом, температурой и количеством вещества в газовой системе. Благодаря своей универсальности и простоте применения, уравнение Менделеева-Клапейрона стало неотъемлемой частью изучения химических и физических процессов.
В химии, уравнение Менделеева-Клапейрона играет важную роль при изучении кинетических итермодинамических свойств газов. Оно позволяет определить такие параметры, как объем газа при заданных давлении и температуре, количество вещества газа в системе и его плотность. При изучении реакций, уравнение Менделеева-Клапейрона часто применяется для определения изменения условий (давление, объем, температура) в результате химических превращений. Это позволяет более глубоко понять процессы, происходящие при реакциях в газовой среде.
В физике, уравнение Менделеева-Клапейрона используется для описания поведения идеальных газов. Это позволяет вычислять различные характеристики газовой системы, включая давление, объем и температуру. Более того, уравнение Менделеева-Клапейрона можно использовать для определения молярной массы газа на основе измеренных данных. Также оно позволяет предсказывать изменение состояния идеального газа при изменении внешних условий.
Проблемы и ограничения при применении уравнения Менделеева-Клапейрона
Возможности уравнения Менделеева-Клапейрона, широко используемого в химии и физике, ограничены некоторыми проблемами. Несмотря на его значительное применение, необходимо учитывать определенные ограничения, которые могут повлиять на точность результатов и уменьшить его применимость в некоторых случаях.
- Влияние идеализаций: Уравнение Менделеева-Клапейрона предполагает идеальное поведение газов и не учитывает ряд важных факторов, таких как силы взаимодействия между молекулами и изменение объема газа при высоких давлениях. Эти идеализации могут привести к неточным результатам при работе с реальными системами.
- Ограничения температуры и давления: Уравнение Менделеева-Клапейрона работает лучше при низких температурах и давлениях. При высоких температурах и давлениях молекулярное движение становится значительным, и уравнение может быть менее точным.
- Неидеальность реальных газов: Уравнение Менделеева-Клапейрона не учитывает неидеальность реальных газов, таких как неконформность эффекта Ван-дер-Ваальса или существование критической точки. Поэтому при работе с реальными газами может потребоваться использование других моделей для обеспечения более точных результатов.
- Ограниченная область применимости: Уравнение Менделеева-Клапейрона может быть применено только к системам, где молекулы действуют как независимые частицы и не взаимодействуют друг с другом. Это ограничивает его применимость в случае реакций или систем, где взаимодействия между молекулами играют важную роль.
При использовании уравнения Менделеева-Клапейрона необходимо учитывать эти проблемы и ограничения, чтобы получить более точные результаты и обеспечить правильность применения уравнения в конкретной ситуации.
Вопрос-ответ

Какая роль играет R в уравнении Менделеева-Клапейрона?
Знак R в уравнении Менделеева-Клапейрона представляет универсальную газовую постоянную и используется для связи между давлением, объемом, температурой и количеством вещества в газовой системе.
Каковы основы использования R в уравнении Менделеева-Клапейрона?
Основы использования R в уравнении Менделеева-Клапейрона основаны на идеальном газовом законе, который устанавливает пропорциональность между давлением, объемом и температурой в газовой системе.
Как применяется уравнение Менделеева-Клапейрона с использованием R?
Уравнение Менделеева-Клапейрона с использованием R применяется для расчета различных параметров газовых систем, таких как давление, объем, температура и количество вещества. Оно используется в различных областях науки и техники, включая химию, физику и инженерию.
Какая формула связывает R с другими параметрами в уравнении Менделеева-Клапейрона?
Формула связывает R с другими параметрами в уравнении Менделеева-Клапейрона выглядит следующим образом: PV = nRT, где P - давление, V - объем, n - количество вещества, T - температура и R - универсальная газовая постоянная.