В углубленной изученности атомного строения предстает перед нами удивительная паутина вещества. Упредмеченная материя, объединенная в микроскопической точке, где притягивание атомных ядер скрепляет потоки электронов, создавая пространство повседневной действительности. В этом маленьком, но невероятно сложном мире скрыта необычная система электрических зарядов, выстраивающаяся в строго определенную конфигурацию. Дерзнем ли мы вглядеться во внутренние закоулки атома, мы несомненно погрузимся в увлекательное исследование строения его электронной оболочки.
Атом – это фундаментальная частица материи, демонстрирующая удивительные качества, будоражащие умы исследователей уже несколько столетий. В этих маленьких, но непостижимо важных образованиях скрыты причины вселенского строения вещества, возможности его превращений и причины наблюдаемых реакций. Свойства атома определяются его внутренним строением, которое состоит из ядра и электронной оболочки.
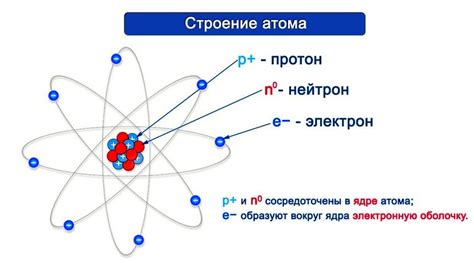
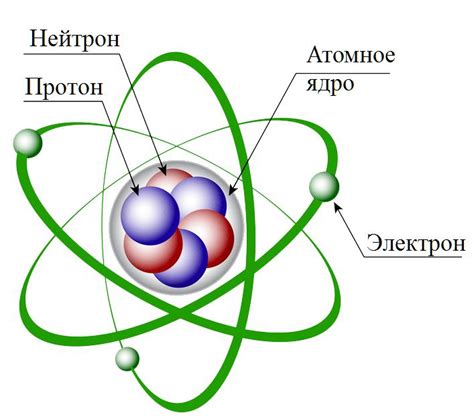
Ядро, окруженное оболочкой, представляет собой невероятно плотную структуру, в которой сосредоточена основная масса атомного вещества. Ядра атомов состоят из двух видов частиц – протонов, обладающих положительным зарядом, и нейтронов, которые являются электрически нейтральными. Но главная изюминка атома скрыта не в его ядре, а в его оболочке – разнообразной системе, состоящей из электронов, вероятностно распределенных вокруг ядра, и разделяющих пространство атомного микрокосмоса.
Фундаментальные элементы атомной структуры: термины и концепции
Прежде чем погрузиться в изучение сложной структуры атома, важно освоить несколько фундаментальных понятий и принципов, которые лежат в основе этой темы. Без понимания этих основных элементов структуры атома, трудно представить себе всю его сложность и взаимодействие его компонентов.
Одним из главных понятий, которое следует усвоить, является "ядро" атома. Ядро, являющееся центральным элементом атома, содержит протоны и нейтроны. Протоны обладают положительным зарядом, а нейтроны не имеют заряда. Сочетание этих частиц в ядре создает уникальную характеристику каждого атома, его атомный номер и массовое число.
Вокруг ядра атома находится электронная оболочка, которая представляет собой область, где движутся электроны. Электроны обладают отрицательным зарядом и обеспечивают электрическую нейтральность атома в целом. Электронная оболочка состоит из различных энергетических уровней, или орбит, на каждом из которых могут находиться определенное количество электронов.
Для более точного описания электронной оболочки атома используется термин "электронная конфигурация". Это упорядоченное распределение электронов по энергетическим уровням и подуровням. Каждый энергетический уровень представляет собой набор подуровней, а каждый подуровень может вместить определенное количество электронов.
Исследование структуры атома позволяет лучше понять его физические и химические свойства. Комбинация ядра, электронной оболочки и электронной конфигурации определяет способность атома образовывать химические связи, его реакционную активность и другие важные характеристики.
Атом - фундаментальная единица материи
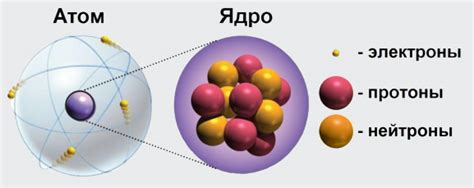
Атом представляет собой минимально возможную единицу химических элементов, которая сохраняет их уникальность и определяет их свойства. Каждый атом состоит из ядра и облака электронов, которые располагаются на электронных оболочках вокруг ядра. Электроны - негативно заряженные элементарные частицы. Ядро атома, в свою очередь, состоит из нейтронов и протонов, нейтроны не имеют заряда, а протоны имеют положительный заряд.
Атомы обладают особым свойством - электромагнитным взаимодействием. Это позволяет им вступать в химические реакции, образуя химические связи с другими атомами для образования различных химических соединений. Каждому химическому элементу соответствует определенное количество протонов в его ядре, которое называется атомным номером элемента. Это идентифицирующая характеристика, по которой элементы располагаются в таблице Менделеева.
Понимание атомной структуры и принципов взаимодействия атомов позволяет объяснить множество явлений, связанных с химическими реакциями, свойствами веществ и электронными процессами. Это является основой для изучения химии и многих других наук, связанных с миром микро- и макроуровней материи.
Важность понимания об оболочках атома и их функции в химии
Электроны: ключевые составные части атомной оболочки
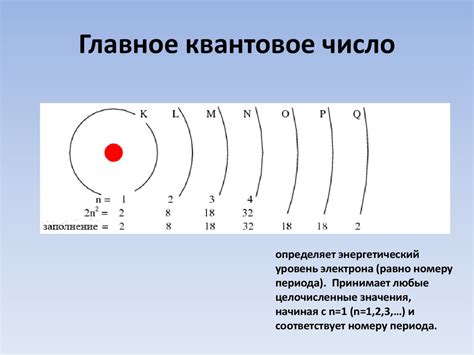
Оболочка атома состоит из нескольких энергетических уровней, которые можно представить в виде энергетической лестницы. Каждый уровень может содержать определенное количество электронов, но чем ближе уровень к ядру, тем меньше энергии он имеет и тем меньше электронов он может содержать.
- Внутренний уровень, или K-уровень, ближайший к ядру, может содержать до двух электронов.
- Следующий уровень, L-уровень, может иметь до восьми электронов.
- Далее идёт M-уровень, на котором может разместиться до восемнадцати электронов.
- На следующем уровне – N-уровень, которому доступно до тридцати двух электронов.
Распределение электронов по уровням и подуровням обусловлено принципами заполнения электронных оболочек, такими как принципы Хунда, Паули и Ауфбау. Эти принципы определяют порядок заполнения и ориентацию электронов на каждом уровне, создавая уникальную структуру оболочки.
Знание о строении оболочки и распределении электронов позволяют предсказывать химические свойства атомов, источники их фото- и радиоактивности, а также различные физические свойства элементов.
Распределение электронов в атоме: основные принципы и закономерности
В данном разделе мы рассмотрим основные принципы и закономерности, которые определяют способ распределения электронов в оболочках атома. Разберем, каким образом электроны заполняют энергетические уровни и подобны ли эти закономерности структуре оболочки.
Внутреннее устройство атома: полные и относительные энергетические уровни

Элементарные частицы, из которых состоит атом, организованы в сложную структуру, которая определяет его энергетические уровни. Эти уровни можно разделить на абсолютные и относительные, каждый из которых имеет свою важную роль в определении поведения атома.
- Абсолютные энергетические уровни - это стационарные состояния атома, которые определяются наличием электронов в его оболочках. Каждый атом может иметь различное количество оболочек и, следовательно, различное количество абсолютных энергетических уровней.
- Относительные энергетические уровни - это состояния атома, которые возникают вследствие взаимодействия с другими атомами или электромагнитным полем. Они могут приводить к изменению положения электронов на абсолютных энергетических уровнях и, соответственно, к изменению поведения атома в реакциях и взаимодействиях.
Важно отметить, что энергетические уровни атома необходимы для поддержания его стабильности и функциональности. Соответствие абсолютных и относительных энергий электронов на уровнях позволяет атому удерживать свою оболочку и участвовать в различных химических процессах. Комплексная система энергетических уровней обеспечивает возможность существования и разнообразия химических элементов в природе.
Атомные уровни энергии: сущность и классификация

Реализация процессов в атоме связана с наличием особых уровней энергии, которые обусловлены сложной динамикой электронных облаков. В данном разделе мы рассмотрим сущность и систему классификации атомных уровней энергии, на которых находятся электроны.
Понимание атомных уровней энергии
Атомная физика отличается высокой степенью сложности, но представление о разбиении атома на различные энергетические уровни помогает нам в изучении его свойств и взаимодействий. Каждый уровень энергии отвечает за наличие электронов в конкретной энергетической области. Переходы электронов между уровнями сопровождаются поглощением или испусканием энергии в виде фотонов, что является основой для атомной спектроскопии.
Классификация атомных уровней энергии
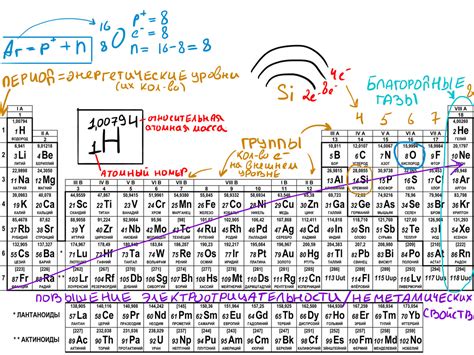
Атомные уровни энергии классифицируются в зависимости от принадлежности электронов к различным оболочкам и подобластям атома. Основными типами уровней энергии являются оболочки K, L, M и так далее. Каждая оболочка включает несколько подуровней, которые могут быть описаны с использованием буквенных обозначений - s, p, d, f и т.д.
Например, уровень энергии 1s представляет собой самый ближайший к ядру атома и содержит два электрона с противоположным спином. Уровень 2p, в свою очередь, располагается на следующей оболочке после 2s и содержит шесть электронов.
Кроме того, атомные уровни энергии могут быть разделены на заполненные и незаполненные. Заполненные уровни обладают целым числом электронов и характеризуются особыми стабильными свойствами, тогда как незаполненные уровни имеют возможность взаимодействия с другими атомами и вызывают химические реакции.
Энергетический аспект оболочки атома: многообразие и взаимодействие уровней энергии
Рассмотрение энергетической структуры оболочки атома приносит понимание о сложной природе электронных нив и их взаимосвязи. Внутри оболочки присутствуют разнообразные энергетические подуровни, которые обусловлены группировкой электронов на определенных уровнях энергии.
Энергетические подуровни могут варьироваться по своему заполнению электронами и количеству энергии, которую они содержат. Каждый подуровень связан с определенными энергетическими значениями, которые представляют собой потенциал для электрона на этом конкретном уровне.
На протяжении исследований было обнаружено, что энергетические подуровни образуют взаимосвязанную структуру, состоящую из различных субподуровней. Каждый субподуровень имеет свою энергию и выступает в качестве дальнейшего уточнения оболочки атома. Такое многообразие подуровней делает электронную оболочку особо сложной и интригующей для научного исследования.
По мере углубления в изучение энергетических подуровней становится ясно, что взаимодействие электронов между собой и с ядром определяет их распределение по оболочке. Энергия электрона и его положение на подуровне зависят от взаимодействия с другими электронами и ядром атома. Это взаимодействие создает сложную взаимосвязь между электронами и сопровождает процесс заполнения энергетических подуровней.
- Энергетические подуровни оболочки атома обладают своеобразной сложностью и многообразием.
- Внутри электронной оболочки присутствуют различные субподуровни, каждый из которых имеет свою энергию и является дополнительным элементом структуры атома.
- Взаимодействие электронов между собой и с ядром влияет на распределение и энергию электронов внутри оболочки атома.
- Понимание энергетических подуровней помогает раскрыть сложность оболочки атома и процесса заполнения электронами.
Правила заполнения электронными парами и отрицательными зарядами

В данном разделе рассмотрим принципы, согласно которым электронные оболочки атомов заполняются электронными парами и отрицательными зарядами. Речь пойдет о способах расположения электронов в энергетических уровнях, их взаимодействии и влиянии на структуру атома.
Как известно, атом состоит из ядра и электронной оболочки, которая охватывает его. Электроны, населяющие оболочку, обладают отрицательным зарядом и размещаются вокруг ядра по определенным правилам. Процесс заполнения электронными парами и отрицательными зарядами сложен и имеет свои особенности.
- Принцип заполнения электронными парами: в соответствии с принципом Паули, каждый энергетический уровень электронной оболочки может содержать не более двух электронов, которые должны иметь различные спиновые ориентации.
- Уровни энергии и подуровни: электронные оболочки разделены на энергетические уровни и подуровни, каждый из которых может содержать определенное количество электронов.
- Принципы заполнения подуровней: подуровни заполняются по возрастанию энергии, начиная с наименьшего. Сначала заполняются субуровни с меньшей энергией, затем субуровни с более высокой энергией.
- Взаимодействие электронов: электроны, занимающие один энергетический уровень или подуровень, взаимодействуют друг с другом и с ядром, влияя на общую структуру атома и его химические свойства.
- Ионизация атома: добавление или удаление электронов из атома приводит к образованию ионов с положительным или отрицательным зарядами.
Понимание принципов заполнения электронными парами и отрицательными зарядами является важным для понимания химических свойств элементов и их взаимодействия в химических реакциях. Эти принципы лежат в основе понятий о периодической системе элементов и структуре атомов различных элементов.
Дополнительные элементы: подкорка и оболочка

Кроме основной структуры электронной оболочки атома, в ней присутствуют дополнительные элементы, играющие важную роль в организации электронных уровней. Речь идет о подкорке и оболочке.
Подкорка представляет собой находящиеся ближе к ядру атома электроны, которые заполняют более низкие энергетические уровни. Они отвечают за химические свойства элементов и участвуют в образовании химических связей. Подкорка формируется основным электронным облаком и включает в себя s- и p-орбитали.
Оболочка – это электронные уровни, расположенные дальше от ядра, которые могут находиться в более высокоэнергетическом состоянии, чем подкорка. В оболочке находятся d- и f-орбитали, которые могут быть заполнены только после заполнения всех нижних электронных уровней. Оболочка играет важную роль в формировании свойств элементов, особенно при образовании соответствующих ионов и химических соединений.
Таким образом, подкорка и оболочка являются неотъемлемыми компонентами электронной оболочки атома, определяющими его химические и физические свойства. Подкорка, находящаяся ближе к ядру, играет роль основного строительного блока, в то время как оболочка, состоящая из более высокоэнергетических уровней, дополняет структуру и вносит особенности в поведение атома.
Вопрос-ответ

Каковы принципы строения электронной оболочки атома?
Принципы строения электронной оболочки атома включают принципы электронного строения, а именно: принцип Паули, принцип взаимного исключения и принцип наименьшей энергии.
Какие вещества образуют электронную оболочку атома?
Электронная оболочка атома образуется электронами, которые вращаются вокруг ядра атома. Электроны образуют электронную оболочку, состоящую из нескольких энергетических уровней, подобно орбитам вокруг ядра.
Какова структура электронной оболочки атома?
Электронная оболочка атома состоит из нескольких энергетических уровней и подуровней. Энергетические уровни обозначаются числами n=1, 2, 3 и так далее, а подуровни обозначаются буквами s, p, d, f и т.д. Каждый энергетический уровень может содержать определенное количество электронов, соответствующее формуле 2n^2, где n - число энергетического уровня. Электроны располагаются на энергетических уровнях по принципу заполнения, начиная с более низких уровней и двигаясь к более высоким.