Ученые уже много лет изучают таинственные процессы, происходящие на молекулярном уровне. Они стремятся понять, как простые вещества могут преобразовываться с поразительной скоростью под влиянием некоторых специальных ингредиентов. Это явление, известное как катализ, открывает перед нами новые горизонты возможностей в области химической трансформации.
В нашей эпохе химии катализаторы играют ключевую роль в современных технологиях. Они не только ускоряют реакции, но и наделяют их селективностью и эффективностью. Вы могли заметить, как быстро горит спичка, как бурно протекает реакция в бактериях или как легко раскрывается сложный парфюмерный аромат на вашей коже. Все это возможно благодаря искусству катализа.
Однако, прежде чем мы погрузимся в глубины этой науки, необходимо разобраться в том, какие факторы и механизмы лежат в основе работы катализаторов. Мы будем исследовать различные виды катализа, как гомогенные, так и гетерогенные, и изучать их взаимодействие с молекулярными системами. Раскрывая эту тайну, мы познаем секреты этого феномена и сможем использовать их для нашей пользы во множестве областей, от промышленности до медицины.
Основные понятия и определения

В данном разделе рассматриваются ключевые термины и определения, связанные с воздействием специального вещества на скорость совершения химических процессов. Здесь представлены базовые понятия, которые помогут разобраться в сути и механизмах катализа, а также понять влияние факторов на данный процесс.
Одним из таких понятий является катализатор – вещество, которое способно влиять на скорость химической реакции, не изменяя при этом своего состава. Взаимодействуя с реагентами, катализатор ускоряет совершение химической реакции, обеспечивает более эффективные пути ее протекания и снижает энергетический барьер, который необходимо преодолеть для достижения реакционного процесса.
Реакционная активность – это способность реагентов взаимодействовать и превращаться в продукты. Она зависит от различных факторов, таких как температура, концентрация реагентов, давление и присутствие катализаторов. Изменение любого из этих факторов может повлиять на скорость протекания реакции и, следовательно, на ее эффективность.
Кинетика реакции – это область химии, изучающая скорость, механизм и закономерности протекания химических реакций. Кинетические законы определяют зависимость скорости реакции от концентрации реагентов и других воздействующих факторов. Изучение кинетики реакций с катализаторами позволяет определить основные механизмы ускорения и эффективного влияния специального вещества на реакционный процесс.
- Катализатор – вещество, влияющее на скорость химической реакции без изменения своего состава.
- Реакционная активность – способность реагентов взаимодействовать и превращаться в продукты.
- Кинетика реакции – наука, изучающая скорость, механизм и закономерности химических реакций.
Взаимосвязь скорости химической реакции с присутствием активного вещества
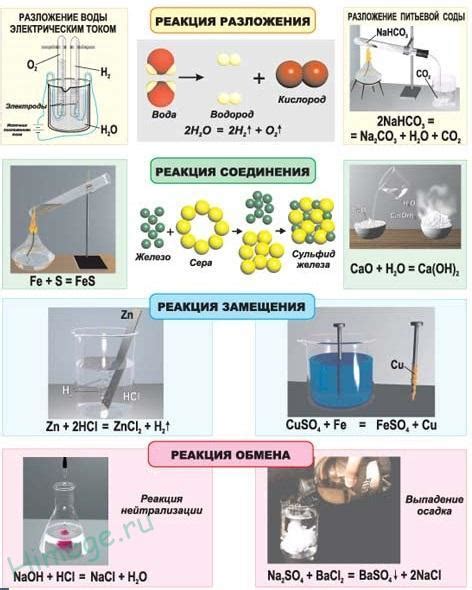
Катализаторы могут активировать реагенты, способствовать рассеиванию энергии активации и образованию промежуточных стадий, что приводит к ускорению химической реакции. В то же время, некоторые катализаторы могут выполнять функцию ингибитора и замедлять скорость реакции. Такое разнообразие эффектов зависит от механизмов действия катализаторов и их взаимодействия с реагентами.
Отбрасывая сложные технические термины, можно сказать, что катализаторы являются активаторами, влияющими на скорость химических реакций без изменения конечного результата. Они могут устранять препятствия на пути реакции или создавать условия для протекания процесса с наименьшими энергетическими затратами.
Также стоит отметить, что скорость реакции заметно зависит от активности и концентрации катализатора. Это означает, что, изменяя условия присутствия катализатора, мы можем контролировать скорость химической реакции и добиться желаемого результата.
Описание экспериментальных наблюдений и результатов исследования

В данном разделе представлены результаты экспериментальных исследований, направленных на изучение воздействия специфических веществ на химические превращения. Проведенные эксперименты были основаны на создании оптимальных условий для изучения синтеза новых соединений и определения влияния катализаторов на скорость химических реакций. В дальнейшем были записаны и проанализированы полученные данные, что позволило выявить основные закономерности и тенденции в изменении скорости реакций при использовании разных катализаторов.
Результаты экспериментов показали, что применение различных катализаторов существенно влияет на скорость химических превращений. Синтез новых соединений под воздействием катализаторов оказался значительно более эффективным по сравнению со стандартными условиями без катализатора. Такие различия в скорости реакций объясняются различными механизмами, связанными с активацией реагентов, изменением энергетических барьеров и образованием промежуточных комплексов.
Более подробный анализ экспериментальных данных позволил выделить несколько факторов, которые оказывают влияние на скорость химических реакций при использовании катализаторов. Одним из таких факторов является концентрация катализатора в реакционной среде. При оптимальном соотношении концентрации катализатора к реагентам удалось достичь максимального ускорения химической реакции.
Кроме того, важным фактором оказалась природа катализатора. Различные вещества обладают разными активностями в качестве катализаторов, что приводит к разным скоростям реакций. Также было обнаружено, что разные типы катализаторов могут активировать различные стадии химической реакции, что приводит к разным механизмам реакций и разным промежуточным продуктам.
В целом, результаты исследования подтверждают, что выбор подходящего катализатора и оптимальных условий реакции играет ключевую роль в контроле скорости химических превращений. Дальнейшее изучение факторов и механизмов влияния катализаторов на скорость реакций позволит эффективно применять катализаторы в различных химических процессах с целью повышения их эффективности и экономии ресурсов.
Основные составляющие, оказывающие воздействие на активность химического катализатора

Во-первых, структура катализатора играет ключевую роль в его активности. Различные формы и размеры активных центров могут обеспечивать различные уровни активности катализатора. Поверхность катализатора также имеет большое значение, поскольку это место, где происходит взаимодействие реагентов.
Во-вторых, количество активных центров на поверхности катализатора оказывает существенное воздействие на его активность. Чем больше активных центров, тем больше реагентов может быть участвующим в химической реакции, что ведет к увеличению скорости реакции.
Третьим важным фактором является природа катализатора. Различные катализаторы обладают различными химическими свойствами и степенью активности. Например, металлические катализаторы с ионами переходных металлов обычно обладают высокой активностью в реакциях окисления и восстановления.
Кроме того, на активность катализатора существенное влияние оказывает его физическое состояние. Катализаторы могут быть представлены в различных формах, таких как порошок, пленка, катализаторы на носителях и т.д. Физическое состояние катализатора определяет его поверхностную активность и доступность для реагентов.
Таким образом, активность катализатора зависит от множества факторов, таких как его структура, количество активных центров, природа и физическое состояние. Понимание и оптимизация этих составляющих способствует повышению эффективности катализаторов и развитию новых методов синтеза и промышленных процессов.
Вещество, количество реагентов, теплота и прочие аспекты влияния на ход реакции

Кроме того, важное значение имеет также концентрация реагентов, которая влияет на частоту столкновений и вероятность реагирования между молекулами. При изменении концентрации реагентов можно достичь более эффективного протекания реакции, что в свою очередь может повысить скорость образования продуктов реакции.
Температура также является одним из ключевых факторов, влияющих на скорость химической реакции. При повышении температуры возрастает кинетическая энергия молекул, что способствует увеличению частоты столкновений и активации сложных химических процессов.
Дополнительно, необходимо упомянуть о воздействии давления и общикающей среды на ход реакции. Увеличение давления может способствовать снижению объема реакционной системы и увеличению вероятности столкновений между молекулами реагентов, что приводит к повышению скорости реакции. Окружающая среда также играет свою роль, так как ее свойства могут изменять активность катализатора и способствовать оптимальному протеканию процесса.
- Материал катализатора
- Концентрация реагентов
- Температура
- Давление
- Окружающая среда
Молекулярные принципы работы катализаторов
Данная часть статьи посвящена разбору сути воздействия катализаторов на молекулярном уровне в ходе химических реакций. В этом контексте рассматриваются различные механизмы, которые катализаторы используют для изменения скорости реакций, не участвуя при этом в окончательном продукте.
Катализаторы воздействуют на молекулярном уровне, активируя реагирующие частицы и предоставляя им возможность проходить через определенные энергетические барьеры. Это может происходить через образование активных центров, связываемых с реакционными стадиями. Такие активные центры могут образовываться на поверхности катализатора или в его объеме, в зависимости от химического механизма действия.
- Поверхностное каталитическое действие проявляется благодаря специфическим активным центрам на поверхности катализатора. Эти центры вступают в реакцию с реагентами и стимулируют их превращение в продукты.
- В случае внутреннего каталитического действия, катализатор способен модифицировать структуру исходных реагентов напрямую в объеме материала. Такое влияние может происходить путем образования промежуточных соединений или активных центров внутри катализатора.
- Помимо этого, катализаторы могут оказывать комбинированное воздействие, сочетая образование активных центров как на поверхности, так и в объеме материала. Такой подход позволяет оптимизировать проходность реагентов через катализатор и повысить эффективность реакции.
На молекулярном уровне катализаторы могут представлять собой множество разнообразных структур, таких как металлы, оксиды, кластеры или комплексы. Каждая из этих структур имеет свои уникальные свойства и способы взаимодействия с реагентами. Это делает исследование механизмов действия катализаторов на молекулярном уровне важной задачей современной химии и катализа.
Особенности каталитических реакций и активации молекул

Каталитические реакции представляют собой процессы, при которых катализатор вступает в реакцию с реагентами, образуя промежуточные комплексы, которые затем разлагаются, возвращая катализатор в его исходное состояние и образуя продукты реакции. Часто такие процессы позволяют снизить температуру, необходимую для успешного протекания реакции, и увеличить выход конечных продуктов.
Активация молекул является ключевым шагом в реализации каталитических реакций. Она представляет собой повышение энергии молекул реагентов, что позволяет преодолеть энергетические барьеры и осуществить превращение. Активация молекул может происходить различными способами и включать в себя изменение их геометрии, поляризацию, деформацию и другие химические трансформации.
Роль катализаторов в промышленности и повседневной жизни
В промышленности: Катализаторы широко используются в различных отраслях промышленности, таких как нефтепереработка, производство пластмасс, химические и фармацевтические отрасли. Например, они часто применяются в процессе крекинга нефти, где они помогают разломить сложные молекулы нефти на более простые и ценные продукты, такие как бензин или дизельное топливо. Катализаторы также используются в процессах синтеза различных химических соединений, которые впоследствии становятся сырьем для производства пластмасс и других материалов.
В повседневной жизни: Неоспоримую роль катализаторов можно увидеть и в нашей повседневной жизни. Например, витамины и ферменты, которые необходимы для нашего здоровья и нормального функционирования организма, являются катализаторами различных биохимических реакций. Катализаторы также присутствуют в обычных бытовых предметах, таких как каталитические конвертеры в автомобилях, которые помогают превращать вредные выбросы из двигателя в менее вредные вещества.
Важно отметить, что катализаторы не только ускоряют реакцию, но и остаются неизменными в конце процесса, что позволяет их повторно использовать и экономить ресурсы. Благодаря своей значимой роли, катализаторы занимают преобладающее место в различных сферах нашей жизни, помогая сделать процессы более эффективными и экологически безопасными.
Вопрос-ответ

Какие факторы могут повлиять на скорость химической реакции при использовании катализатора?
Факторы, которые могут влиять на скорость химической реакции с использованием катализатора, включают: тип катализатора, концентрацию катализатора, температуру реакции, присутствие ингибиторов или промоторов, а также свойства реагентов и растворителя.
Как катализатор ускоряет химическую реакцию?
Катализатор ускоряет химическую реакцию, предоставляя альтернативные пути реакции с более низкой энергией активации. Он образует промежуточные соединения с реагентами и позволяет им проскочить через высокоэнергетический барьер реакции, что снижает энергию активации и увеличивает скорость реакции.
Какие механизмы могут быть у катализаторов?
Катализаторы могут действовать по разным механизмам, включая поверхностный катализ, гомогенный катализ и ферментативный катализ. В поверхностном катализе реакция происходит на поверхности катализатора. В гомогенном катализе катализатор полностью растворен в реакционной среде. Ферментативный катализ осуществляется ферментами в биологических системах.